题目内容
【题目】下列说法正确的是
A.反应中,被氧化的物质是氧化剂
B.氧化还原反应的本质是电子的转移
C.某物质的元素在反应中失去电子,则此物质是氧化剂
D.氧化还原反应中,一种元素被氧化一定有另一种元素被还原
【答案】B
【解析】
A.反应中,被氧化的物质是还原剂,A错误;
B.氧化还原反应的本质是电子的转移,B正确;
C.某物质的元素在反应中失去电子,则此物质是还原剂,C错误;
D.氧化还原反应可发生在同一种元素之间,如Cl2+H2O=HCl+HClO,D错误;
答案选B。

【题目】针对下面10种元素,完成以下各小题.
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | C | N | O | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)地壳中含量最多的元素是(填名称).
(2)最高价氧化物对应的水化物碱性最强的是(填化学式).
(3)Al的原子结构示意图为 .
(4)S和Cl相比,元素非金属性较强的是 .
(5)可用来制造光导纤维的物质是 , 晶体硅的主要用途是(写出一种).
(6)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3 , 请写出反应的化学方程式: .
【题目】低碳经济是以低能耗、低污染、低排放为基础的经济模式,低碳经济的概念在中国正迅速从高端概念演变成全社会的行为,在新能源汽车、工业节能等多个领域都大有作为.请运用化学反应原理的相关知识研究碳及其化合物的性质
(1)工业上可利用CO或CO2来制备燃料甲醇.
已知:800℃时,化学反应①、反应②对应的平衡常数分别为2.5、1.0
反应①:2H2(g)+CO(g)CH3OH(g)△H=-90.8kJmol-1
反应②:H2(g)+CO2(g)H2O(g)+CO(g)△H=+41.2kJmol-1
写出用CO2与H2反应制备甲醇的热化学方程式___________.
800℃时该反应的化学平衡常数K的数值为___________.
(2)现将不同量的CO2(g)和H2(g)分别通入到容积为2L的恒容密闭容器中发生反应: CO(g)+H2O(g)CO2(g)+H2(g)ΔH=+41.2KJ/mol,得到如下二组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO2(g) | H2(g) | H2O(g) | CO2(g) | |||
1 | 900 | 4 | 2 | 1.6 | 2.4 | 2 |
2 | 900 | a | b | c | d | t |
实验2中,若平衡时,CO2(g)的转化率小于H2(g).则a、b必须满足的关系是__________。
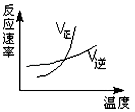
若在900℃时,另做一组实验,在此容器中加入10molCO2(g),5molH2,2molCO,5molH2O(g),则此时v正____v 逆(填“<”>“或“=”)。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:CH3OH(g)+CO(g) ![]() HCOOCH3(g) ΔH=-29.1 kJ·mol-1,科研人员对该反应进行了研究,部分研究结果:
HCOOCH3(g) ΔH=-29.1 kJ·mol-1,科研人员对该反应进行了研究,部分研究结果:
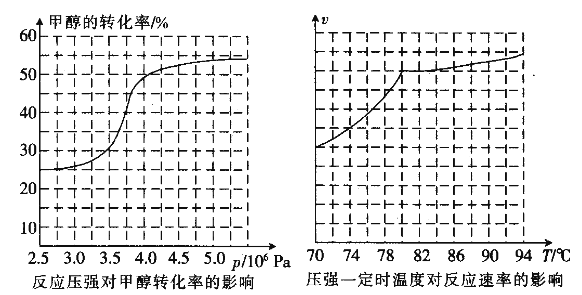
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是________。 (填“3.5×106 Pa”、 “4.0×106 Pa”或““5.0×106 Pa”)。
②实际工业生产中采用的温度是80℃,其理由是_________________。
(4)常温下,向20.0mLcmol/L的氨水中滴加20mL.0.2mol/LHNO3溶液后,恰好使溶液显中性(设混合溶液总体积为两溶液体积之和)。计算常温下NH3·H2O![]() NH4++OH-的电离平衡常数K(NH3·H2O)=_________(用含c的式子表示)。
NH4++OH-的电离平衡常数K(NH3·H2O)=_________(用含c的式子表示)。