题目内容
14.用NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 1 mol OH-中含有10NA个电子 | |
| B. | 46g的NO2气体中含有NA个NO2分子 | |
| C. | 1 L 1 mol/L的AlCl3溶液中含有NA个Al3+ | |
| D. | 常温常压下11.2 L的甲烷气体含有的分子数为0.5NA |
分析 A、氢氧根为10电子微粒;
B、NO2气体中存在平衡:2NO2?N2O4,导致分子个数减小;
C、Al3+是弱碱阳离子,在溶液中会水解;
D、常温常压下,气体摩尔体积大于22.4L/mol;
解答 解:A、氢氧根为10电子微粒,故1mol氢氧根中含10mol电子即10NA个,故A正确;
B、NO2气体中存在平衡:2NO2?N2O4,导致分子个数减小,故46g二氧化氮气体中的分子数小于NA个,故B错误;
C、Al3+是弱碱阳离子,在溶液中会水解,故溶液中的铝离子的个数小于NA个,故C错误;
D、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L甲烷的物质的量小于0.5mol,则分子数小于0.5NA个,故D错误.
故选A.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
相关题目
19. 下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)
下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)
( )
 下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)
下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)| a | b | c | d | |
| ① | Si | SiO2 | H2SiO3 | Na2SiO3 |
| ② | N2 | NO | NO2 | HNO3 |
| ③ | Cu | CuO | Cu(OH)2 | CuSO4 |
| ④ | Na | NaOH | Na2CO3 | NaHCO3 |
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
3.某原电池装置如图所示.下列说法正确的是( )


| A. | 石墨棒为负极 | B. | 工作时电能转化为化学能 | ||
| C. | 锌片的质量减少 | D. | 电子从石墨棒流向铁片 |
4.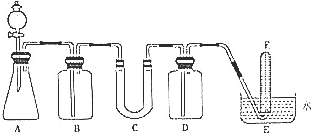 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品、用图中的实验装置进行实验,证明过氧化钠可作供氧剂.
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品、用图中的实验装置进行实验,证明过氧化钠可作供氧剂.
(1)填写表中空格:
(2)在上述某一装置中,11.6g CO2和水蒸气的混合气体与足量的Na2O2充分反应后,固体质量增加了3.6g,则原混合气体的平均相对分子质量为23.2
A.5.8 B.11.6 C.23.2 D.46.4
(3)试管F收集满气体后,下一步实验操作是把F中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气
(4)某人按下列方程测定样品中Na2O2的含量:称取一定量样品溶于足量的水,发生反应:Na2O2+2H2O=2NaOH+H2O2,2H2O2$\frac{\underline{\;NaOH\;}}{\;}$2H2O+O2↑,根据生成O2的量计算样品中Na2O2的纯度,他仔细实验过多次,得到的Na2O2含量均明显低于实际含量,这是因为B.
A.称量错误
B.H2O2分解不完全
C.Na2O2转化为H2O2和NaOH的反应不完全
D.装置漏气.
 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品、用图中的实验装置进行实验,证明过氧化钠可作供氧剂.
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品、用图中的实验装置进行实验,证明过氧化钠可作供氧剂.(1)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | 除去CO2气体中混入的HCl |
| C | 石棉绒与过氧化钠 | 与CO2和水气反应,产生O2 |
| D | NaOH | 吸收未反应的CO2气体 |
A.5.8 B.11.6 C.23.2 D.46.4
(3)试管F收集满气体后,下一步实验操作是把F中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气
(4)某人按下列方程测定样品中Na2O2的含量:称取一定量样品溶于足量的水,发生反应:Na2O2+2H2O=2NaOH+H2O2,2H2O2$\frac{\underline{\;NaOH\;}}{\;}$2H2O+O2↑,根据生成O2的量计算样品中Na2O2的纯度,他仔细实验过多次,得到的Na2O2含量均明显低于实际含量,这是因为B.
A.称量错误
B.H2O2分解不完全
C.Na2O2转化为H2O2和NaOH的反应不完全
D.装置漏气.
 使用如图所示装置进行化学小实验,请填写下列空白:
使用如图所示装置进行化学小实验,请填写下列空白: