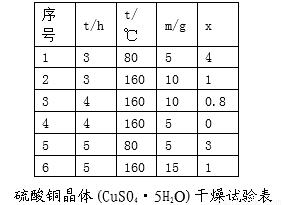
题目内容
下列说法不正确的是
A.在常温下SiO2(s)+2C(s)=Si(s)+2CO(g)不能自发进行,则该反应的∆H>0
B.常温下,NH4Cl溶液加水稀释,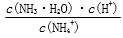 不变
不变
C.向硅酸钠溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了水解
D.如图可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化

练习册系列答案
相关题目
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
物质 组别 | 甲 | 乙 | 丙 |
A | Mg | FeSO4 | O2 |
B | Cl2 | H2O | NH3 |
C | Fe | H2O | FeCl3 |
D | NaHCO3 | Ca(OH)2 | Na2CO3 |


 所含分子数为0.1 NA
所含分子数为0.1 NA

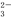 +I2=S4O
+I2=S4O +2I-)
+2I-)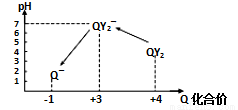
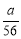 NA
NA

 )
)