题目内容
(16分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F,其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。A、C两元素可形成非极性分子AC2。E、F两元素同周期、同族,且原子序数相差2。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。
(3)写出化合物AC2的结构式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E原子的核外电子排布式是 ,
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
(6)若A与B两元素组成的晶体M,已知M具有与A元素形成的晶体相似的空间网状结构,请你判断晶体M与A元素的晶体硬度大小关系是:M A晶体(填>、<、=),并说明理由:________________ _ _______________。
(16分)(1) C<O<N 。 (2)三角锥形 (3) O=C=O;N2O 。
(4)1s22s22p63s23p63d64s2 (5)10HNO3+4Mg==4Mg(NO3)+NH4NO3+3H2O。
(6)>
【解析】A、C两元素可形成非极性分子AC2,说明A是C,C是O,D的二价阳离子与C的阴离子具有相同的电子层结构,所以D是Mg。E、F两元素同周期、同族,且原子序数相差2,所以E是铁,F是Ni。
(1)非金属性越强,第一电离能越大。但由于N元素的2p轨道电子是半充满状态,稳定性强,所以第一电离能大于O元素的,即C<O<N。
(2)氨气分子中N原子含有1对孤对电子,所以是三角锥形结构。
(3)CO2分子含有2和双键,所以结构式为O=C=O。价电子数和原子数分别都相等的是等电子体,因此应该是N2O。
(4)根据构造原理可知,铁的核外电子排布式是1s22s22p63s23p63d64s2。
(5)N元素的最低价态是-3价,所以方程式为10HNO3+4Mg==4Mg(NO3)+NH4NO3+3H2O。
(6)根据题意可知,M形成的晶体是原子晶体。由于碳原子半径大于氮原子半径,所以M中的共价键强于金刚石中的共价键,即M的硬度大于金刚石的。

 阅读快车系列答案
阅读快车系列答案(16分。每空格2分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出A、B、C三种元素电负性由大到小的顺序 。
(2)由A、B、C和氢四种元素组成的某种离子晶体,1mol该晶体含有配位键2mol,该晶体的化学式是 。
(3)F和Mn(锰)两元素的部分电离能数据列于下表:预测a b(填“大于”、“小于”、“等于”)
理由是
| 元素 | Mn | F | |
| 电离能 ( 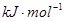 ) ) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | a | b | |
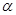 键和
键和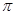 键数目比为 ;
键数目比为 ;AC2分子中A原子的杂化方式是 。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| | 熔点/K | 沸点/K | 标准状况时在水中的溶解度 |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
①熔点、沸点差异的主要原因
②在水中的溶解度差异的主要原因
(16分。每空格2分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出A、B、C三种元素电负性由大到小的顺序 。
(2)由A、B、C和氢四种元素组成的某种离子晶体,1mol该晶体含有配位键2mol,该晶体的化学式是 。
(3)F和Mn(锰)两元素的部分电离能数据列于下表:预测a b(填“大于”、“小于”、“等于”)
理由是
|
元素 |
Mn |
F |
|
|
电离能 ( |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
a |
b |
(4)AC2分子中 键和
键和 键数目比为
;
键数目比为
;
AC2分子中A原子的杂化方式是 。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
|
|
熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
H2S |
187 |
202 |
2.6 |
|
H2C2 |
272 |
423 |
以任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因是:
①熔点、沸点差异的主要原因
②在水中的溶解度差异的主要原因
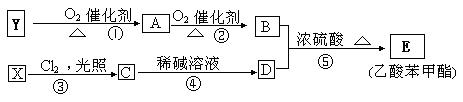
 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
 )
)