题目内容
蛇纹石矿可看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制碱式碳酸镁的实验步骤如下:
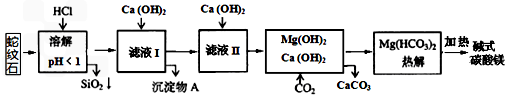
室温下,相关金属氢氧化物沉淀的KSP见下表1
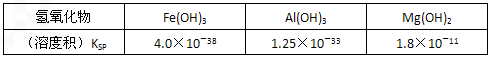
注:① lg2=0.3,②离子的浓度小于1.0×10-5 mol·L-1时 ,可认为该离子沉淀完全。下列说法不正确的是
[ ]
A.在滤液I中,不能加过量的Ca(OH)2是为了防止Al(OH)3溶解和Mg2+沉淀
B.滤液I中,加Ca(OH)2后Al3+比Fe3+先沉淀完全
C.室温下,用Ca(OH)2把滤液I的pH调节到4.7时,Al3+刚好沉淀完全
D.称18.2g碱式碳酸镁【aMgCO3·b Mg(OH)2·cH2O】高温加热分解得到6.6g CO2和8.0g MgO,由此可知a=3、b=1、c=3
B.滤液I中,加Ca(OH)2后Al3+比Fe3+先沉淀完全
C.室温下,用Ca(OH)2把滤液I的pH调节到4.7时,Al3+刚好沉淀完全
D.称18.2g碱式碳酸镁【aMgCO3·b Mg(OH)2·cH2O】高温加热分解得到6.6g CO2和8.0g MgO,由此可知a=3、b=1、c=3
B

练习册系列答案
 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
蛇纹石矿可看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制碱式碳酸镁的实验步骤如下: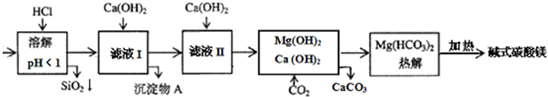 室温下,相关金属氢氧化物沉淀的KSP见下表1
|
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成,由蛇纹石制取碱式碳酸镁的实验步骤如下:

(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是 。
(2)进行Ⅰ操作时,控制溶液的pH=7~8(有关氢氧化物沉淀的pH见下表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致 溶解,产生 沉淀。
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
9.4 |
(3)从沉淀混合物A中提取红色氧化物作为颜料,先向沉淀物A中加入 (填加入物质的化学式),然后 (依此填写实验操作名称)。物质循环使用,能节约资源。上述实验中,可以循环使用的物质是 (填写物质的化学式)。
(4)现设计实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值。请写出下列实验步骤中所需要测定的项目(可用试剂:浓硫酸、碱石灰、氢氧化钠溶液、澄清石灰水):①样品称量,②高温分解,③ ,④ ,⑤MgO称量。
(5)从下列仪器(装有必要的试剂)中选择完成上述实验所必需的仪器,连接一套装置 (选择仪器代号,可重复使用,用“A→B→……→”表示)
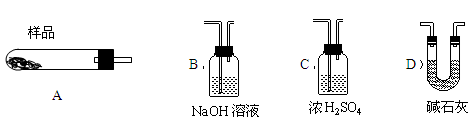
(6)18.2g产品完全分解后,产生6.6gCO2和8.0gMgO,由此可知,产品的化学式中a= ,b= ,c= 。