题目内容
(1)在下列反应中,用序号填空:
A.2F2+2H2O=4HF+O2 B.2Na+2H2O=2NaOH+H2↑
C.CaO+H2O=Ca(OH)2 D.2H2O
2H2↑+O2↑
水只作氧化剂的是
(2)用“双线桥法”表示下列反应中电子转移的方向和总数.
Fe2O3+3CO
2Fe+3CO2
(3)用“单线桥法”表示下列反应中电子转移的方向和总数
Cu+4HNO3(浓)
Cu(NO3)2+2NO2↑+2H2O
(4)赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应发生:Cu2S+2Cu2O
6Cu+SO2↑,该反应中氧化产物与还原产物的质量比
A.2F2+2H2O=4HF+O2 B.2Na+2H2O=2NaOH+H2↑
C.CaO+H2O=Ca(OH)2 D.2H2O
| ||
水只作氧化剂的是
B
B
,水只作还原剂的是A
A
,水既作氧化剂又作还原剂的是D
D
,水既不作氧化剂又不作还原剂的是C
C
.(2)用“双线桥法”表示下列反应中电子转移的方向和总数.
Fe2O3+3CO
| ||
(3)用“单线桥法”表示下列反应中电子转移的方向和总数
Cu+4HNO3(浓)
| ||
(4)赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应发生:Cu2S+2Cu2O
| ||
6:1
6:1
.分析:(1)氧化还原反应中水中H元素的化合价降低,则水作氧化剂,水中O元素的化合价升高,则水作还原剂;
(2)根据元素的化合价变化及电子转移的数目来用“双线桥法”表示反应中电子转移的方向和总数,箭头的起点和终点都指向同种元素;
(3)根据元素的化合价变化及电子转移的数目来用“单线桥法”表示反应中电子转移的方向和总数,箭头由失去电子的元素指向得到电子的元素;
(4)根据元素的化合价变化来分析氧化还原反应,并利用原子守恒来分析氧化产物与还原产物的质量比.
(2)根据元素的化合价变化及电子转移的数目来用“双线桥法”表示反应中电子转移的方向和总数,箭头的起点和终点都指向同种元素;
(3)根据元素的化合价变化及电子转移的数目来用“单线桥法”表示反应中电子转移的方向和总数,箭头由失去电子的元素指向得到电子的元素;
(4)根据元素的化合价变化来分析氧化还原反应,并利用原子守恒来分析氧化产物与还原产物的质量比.
解答:解:(1)A中F元素的化合价降低,O元素的化合价升高,则水只作还原剂;
B中Na元素的化合价升高,H元素的化合价降低,则水只作氧化剂;
C中各元素的化合价都没有发生变化,属于非氧化还原反应,则水既不作氧化剂又不作还原剂;
D中H元素的化合价降低,O元素的化合价升高,则水既作氧化剂又作还原剂;
故答案为:B;A;D;C;
(2)在反应Fe2O3+3CO
2Fe+3CO2中,Fe元素的化合价由+3降低为0,得2×3e-,C元素的化合价由+2升高到+4,失3×2e-,则
用“双线桥法”表示反应中电子转移的方向和总数为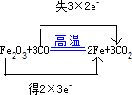 ,答:用“双线桥法”表示反应中电子转移的方向和总数为
,答:用“双线桥法”表示反应中电子转移的方向和总数为 ;
;
(3)在反应Cu+4HNO3(浓)
Cu(NO3)2+2NO2↑+2H2O中,Cu元素的化合价由0升高到+2价,失2e-,N元素的化合价由+5价降低为+4价,得2×e-,则
用“单线桥法”表示反应中电子转移的方向和总数为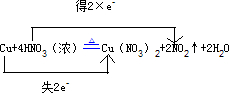 ,
,
答:用“单线桥法”表示反应中电子转移的方向和总数为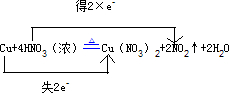 ;
;
(4)Cu2S+2Cu2O
6Cu+SO2↑中6个Cu原子得到电子,1个S原子失去电子,该反应中的还原产物为Cu,氧化产物为SO2,其物质的量之比为6:1,
则反应中氧化产物与还原产物的质量比为6mol×64g/mol:1mol×64g/mol=6:1,故答案为:6:1.
B中Na元素的化合价升高,H元素的化合价降低,则水只作氧化剂;
C中各元素的化合价都没有发生变化,属于非氧化还原反应,则水既不作氧化剂又不作还原剂;
D中H元素的化合价降低,O元素的化合价升高,则水既作氧化剂又作还原剂;
故答案为:B;A;D;C;
(2)在反应Fe2O3+3CO
| ||
用“双线桥法”表示反应中电子转移的方向和总数为
 ,答:用“双线桥法”表示反应中电子转移的方向和总数为
,答:用“双线桥法”表示反应中电子转移的方向和总数为 ;
;(3)在反应Cu+4HNO3(浓)
| ||
用“单线桥法”表示反应中电子转移的方向和总数为
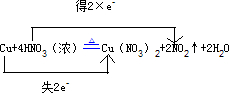 ,
,答:用“单线桥法”表示反应中电子转移的方向和总数为
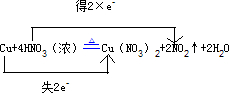 ;
;(4)Cu2S+2Cu2O
| ||
则反应中氧化产物与还原产物的质量比为6mol×64g/mol:1mol×64g/mol=6:1,故答案为:6:1.
点评:本题考查氧化还原反应,明确常见元素的化合价及反应中元素的化合价变化是解答本题的关键,难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
 2H2↑+O2↑。其中(填序号):
2H2↑+O2↑。其中(填序号): 2H2↑+O2↑
2H2↑+O2↑ 2Fe+3CO2
2Fe+3CO2 Cu(NO3)2+2NO2↑+2H2O
Cu(NO3)2+2NO2↑+2H2O 6Cu+SO2↑,该反应中氧化产物与还原产物的质量比______.
6Cu+SO2↑,该反应中氧化产物与还原产物的质量比______.