题目内容
某金属单质与一定浓度的HNO3反应,假定只有单一的还原产物,当参加反应的单质与被还原的HNO3物质的量之比为3:2时,还原产物
| A.NO2 | B.NO | C.N2O | D.N2 |
B
试题分析:设参加反应的单质是3mol,则被还原的硝酸就是2mol。如果金属失去1个电子,则根据电子的得失守恒可知,硝酸得到3÷2=1.5个电子;如果金属失去2个电子,硝酸得到3×2÷2=3个电子,其还原产物是NO;如果失去3个电子,硝酸得到3×3÷2=4.5个电子,所以答案选B。
点评:在进行氧化还原反应的有关计算时,需要根据电子的得失守恒这一关系式进行列式计算。

练习册系列答案
相关题目
 mol
mol mol
mol Mn
Mn H2O → MnO
H2O → MnO Xe↑
Xe↑
 mL 0.1mol·L
mL 0.1mol·L Mn
Mn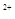 的水溶液中,刚好完全反应。
的水溶液中,刚好完全反应。 。
。