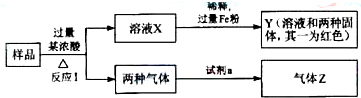
题目内容
由两种金属组成的混合物4.8g,跟氯气完全反应时,消耗氯气2.24L(标准状况),则混合物的组成可能是
- A.镁和铁
- B.钠和铝
- C.锌和铜
- D.铁和铜
D
分析:两种金属的混合物共4.8克,与足量氯气反应后,消耗氯气为2.24L,物质的量为0.1mol,故反应中,4.8g金属提供0.2mol电子,故提供1mol电子需要金属的平均质量为4.8g×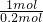 =24g,据此计算提供1mol需要各金属的质量,利用平均值法判断.
=24g,据此计算提供1mol需要各金属的质量,利用平均值法判断.
解答:两种金属的混合物共4.8克,与足量氯气反应后,消耗氯气为2.24L,物质的量为0.1mol,故反应中,4.8g金属提供0.2mol电子,故提供1mol电子需要金属的平均质量为4.8g×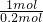 =24g,
=24g,
A、提供1mol电子需要金属Mg的物质的量为0.5mol,质量为0.5mol×24g/mol=12g.提供1mol电子需要金属Fe的物质的量为 mol,质量为
mol,质量为 mol×56g/mol=18.7g,二者混合提供1mol电子的平均质量介于12g~18.7g之间,故A不符合;
mol×56g/mol=18.7g,二者混合提供1mol电子的平均质量介于12g~18.7g之间,故A不符合;
B、提供1mol电子需要金属Na的物质的量为1mol,质量为1mol×23g/mol=23g.提供1mol电子需要金属Al的物质的量为 mol,质量为
mol,质量为 mol×27g/mol=9g,二者混合提供1mol电子的平均质量介于9g~23g之间,故B不符合;
mol×27g/mol=9g,二者混合提供1mol电子的平均质量介于9g~23g之间,故B不符合;
C、提供1mol电子需要金属Zn的物质的量为0.5mol,质量为0.5mol×65g/mol=32.5g.提供1mol电子需要金属Cu的物质的量为0.5mol,质量为0.5mol×64g/mol=32g,二者混合提供1mol电子的平均质量介于32g~32.5g之间,故C不符合;
D、提供1mol电子需要金属Fe的物质的量为 mol,质量为
mol,质量为 mol×56g/mol=18.7g,提供1mol电子需要金属Cu的物质的量为0.5mol,质量为0.5mol×64g/mol=32g,二者混合提供1mol电子的平均质量介于18.7g~32g之间,故D符合;
mol×56g/mol=18.7g,提供1mol电子需要金属Cu的物质的量为0.5mol,质量为0.5mol×64g/mol=32g,二者混合提供1mol电子的平均质量介于18.7g~32g之间,故D符合;
故选D.
点评:本题考查混合物的计算,难度中等,注意利用提供1mol电子需要金属质量的平均值进行的判断,注意反应金属的化合价.
分析:两种金属的混合物共4.8克,与足量氯气反应后,消耗氯气为2.24L,物质的量为0.1mol,故反应中,4.8g金属提供0.2mol电子,故提供1mol电子需要金属的平均质量为4.8g×
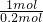 =24g,据此计算提供1mol需要各金属的质量,利用平均值法判断.
=24g,据此计算提供1mol需要各金属的质量,利用平均值法判断.解答:两种金属的混合物共4.8克,与足量氯气反应后,消耗氯气为2.24L,物质的量为0.1mol,故反应中,4.8g金属提供0.2mol电子,故提供1mol电子需要金属的平均质量为4.8g×
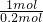 =24g,
=24g,A、提供1mol电子需要金属Mg的物质的量为0.5mol,质量为0.5mol×24g/mol=12g.提供1mol电子需要金属Fe的物质的量为
 mol,质量为
mol,质量为 mol×56g/mol=18.7g,二者混合提供1mol电子的平均质量介于12g~18.7g之间,故A不符合;
mol×56g/mol=18.7g,二者混合提供1mol电子的平均质量介于12g~18.7g之间,故A不符合;B、提供1mol电子需要金属Na的物质的量为1mol,质量为1mol×23g/mol=23g.提供1mol电子需要金属Al的物质的量为
 mol,质量为
mol,质量为 mol×27g/mol=9g,二者混合提供1mol电子的平均质量介于9g~23g之间,故B不符合;
mol×27g/mol=9g,二者混合提供1mol电子的平均质量介于9g~23g之间,故B不符合;C、提供1mol电子需要金属Zn的物质的量为0.5mol,质量为0.5mol×65g/mol=32.5g.提供1mol电子需要金属Cu的物质的量为0.5mol,质量为0.5mol×64g/mol=32g,二者混合提供1mol电子的平均质量介于32g~32.5g之间,故C不符合;
D、提供1mol电子需要金属Fe的物质的量为
 mol,质量为
mol,质量为 mol×56g/mol=18.7g,提供1mol电子需要金属Cu的物质的量为0.5mol,质量为0.5mol×64g/mol=32g,二者混合提供1mol电子的平均质量介于18.7g~32g之间,故D符合;
mol×56g/mol=18.7g,提供1mol电子需要金属Cu的物质的量为0.5mol,质量为0.5mol×64g/mol=32g,二者混合提供1mol电子的平均质量介于18.7g~32g之间,故D符合;故选D.
点评:本题考查混合物的计算,难度中等,注意利用提供1mol电子需要金属质量的平均值进行的判断,注意反应金属的化合价.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
 (2012?洛阳二模)如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电导线材料,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答:
(2012?洛阳二模)如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电导线材料,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答:

 (2012?长宁区二模)短周期中常见金属X、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用).根据题意完成下列填空:
(2012?长宁区二模)短周期中常见金属X、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用).根据题意完成下列填空: