题目内容
【题目】下列依据热化学方程式得出的结论正确的是( )
A.已知2H2(g)+O2(g)=2H2O(g);△H=﹣483.6 kJmol﹣1氢气的燃烧热为241.8 kJmol﹣1
B.已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l);△H=﹣57.4 kJmol﹣1 , 则含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ/mol的热量
C.已知C(石墨,s)=C(金刚石,s);△H>0 则石墨比金刚石稳定
D.己知C(s)+O2(g)=CO2(g);△H1C(s)+1/2O2(g)=CO(g);△H2 , 则△H1>△H2
【答案】C
【解析】解:A.选项中生成的水是气体,应该是液态水,所以不能得出氢气的燃烧热是241.8 kJ/mol,故A错误; B.已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l)△H=﹣57.4 kJ/mol,则含20.0g NaOH物质的量为0.5mol的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,故B错误;
C.已知C(石墨,s)=C(金刚石,s)△H>0,反应是吸热反应,石墨能量低于金刚石,能量越低越稳定,所以石墨比金刚石稳定,故C正确;
D.已知C(s)+O2(g)=CO2(g)△H1①,C(s)+ ![]() O2(g)=CO(g)△H2 ②,①﹣②得到:CO(g)+
O2(g)=CO(g)△H2 ②,①﹣②得到:CO(g)+ ![]() O2(g)=CO2(g)△H1﹣△H2 , 一氧化碳燃烧生成二氧化碳是放热反应,焓变是负值,所以△H1<△H2 , 故D错误,
O2(g)=CO2(g)△H1﹣△H2 , 一氧化碳燃烧生成二氧化碳是放热反应,焓变是负值,所以△H1<△H2 , 故D错误,
故选C.

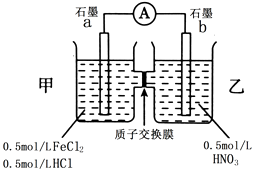
【题目】某学习小组通过下面的实验一和实验二,探究某些化学理论.
(1)实验一:以反应2Fe3++2I﹣=2Fe2++I2为例, 探究该反应是否为可逆反应.
实验方法:在KI溶液中滴加3mLFeCl3溶液,将混合液均
匀分到甲、乙、丙三支试管中;往试管甲中滴加淀粉
溶液,往试管乙中滴加KSCN溶液.如图所示: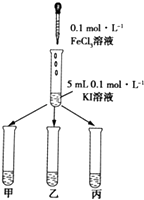
若试管甲中出现现象;
乙试管中出现现象,
则说明该反应为可逆反应.
(2)实验二:实验室制备CO2的反应.实验过程中的数据及相关信息如下表:
序号 | 反应温度/℃ | C(HCl)/molL﹣1 | V(HCl)/mL | 10g碳酸钙的形状 | t/min |
① | 20 | 2 | 10 | 块状 | t 1 |
② | 20 | 4 | 10 | 块状 | t 2 |
③ | 20 | 2 | 10 | 粉末 | t 3 |
④ | 40 | 2 | 10 | 粉末 | t 4 |
⑤ | 40 | 4 | 10 | 粉末 | t5 |
※t表示收集相同状况下体积都为a mL CO2所需的时间※
(i)由表格中的信息可知实验二的目的是探究
(ii)实验①和实验②是探究对该化学反应速率的影响,分析表格中的信息可知,对该化学反应速率的影响因素还有
(iii)收集a mL CO2所需的时间最少的实验是(填实验序号)
【题目】某实验小组同学模拟工业制碘的方法,探究ClO3﹣和I﹣的反应规律.实验操作及现象如表:
实验及试剂 | 编号 | 无色NaClO3 | 试管中 | 淀粉KI |
| 1 | 0.05 mL | 浅黄色 | 无色 |
2 | 0.20 mL | 深黄色 | 无色 | |
3 | 0.25 mL | 浅黄色 | 蓝色 | |
4 | 0.30 mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如图实验: 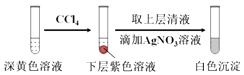
经检验,上述白色沉淀是AgCl.写出加入0.20mL NaClO3后,溶液中ClO3﹣和I﹣发生反应的离子方程式: .
(2)查阅资料:一定条件下,I﹣和I2都可以被氧化成IO3﹣ .
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)
中的反应产物继续反应,同时生成Cl2 .
进行实验:
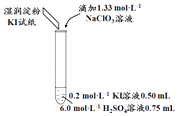
①取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3﹣ . 
其中试剂X可以是(填字母序号).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2 , 便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33molL﹣1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是 , 进一步佐证实验4中生成了Cl2 . 获得结论:NaClO3溶液用量增加导致溶液褪色的原因是(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
编号 | 6.0 molL﹣1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25 mL | 浅黄色 | 无色 |
6 | 0.85 mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是 .
②用离子方程式解释实验6的现象: .