��Ŀ����
����Ŀ��Ԫ�������ڱ��е�λ�ã���ӳ��Ԫ�ص�ԭ�ӽṹ��Ԫ�ص����ʡ���ͼ��Ԫ�����ڱ���һ���֡�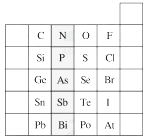
��1����Ӱ����Ԫ����Ԫ�����ڱ��е�λ��Ϊ�塣
��2������Ԫ��������Ԥ�⣺H3AsO4����ǿ�ỹ�������
��3��C��SiԪ�ص��⻯�ﶼ����ȼ�գ���SiԪ�ص��⻯���ڿ����п�����ȼ����ԭ��������д��Si���⻯����ȫȼ�յĻ�ѧ����ʽ����
��4��O2��H2�ķ�Ӧ�Dz����淴Ӧ����S��H2��Ӧ��һ���ȣ���д��Se��H2��Ӧ�Ļ�ѧ����ʽ����
��5���ԱȽ�S��O��F����Ԫ�ص�ԭ�Ӱ뾶��С��(��Ԫ�ط���)��
���𰸡�
��1���ڢ�A
��2������
��3��SiH4���ȶ���С��CH4��SiH4��2O2 ![]() SiO2��2H2O
SiO2��2H2O
��4��Se��H2 ![]() H2Se
H2Se
��5��S>O>F
����������(1)ͼ����Ӱ����Ϊ����Ԫ�أ����ڢ�A�塣(2)�����ڱ��У���Ԫ�صķǽ����Ա���Ԫ����������������ǿ�ᣬ��H3AsO4�������ᡣ(3)����(CH4)ȼ�ղ���������̼��ˮ������(SiH4)��������������ƣ����ڿ�����ȼ�յIJ���Ӧ����ˮ������������SiH4��2O2 ![]() SiO2��2H2O��(4)ͬ����Ԫ�ش��ϵ��·ǽ�������������S��H2��Ӧ��һ���ȡ����ڿ��淴Ӧ����Se��H2��ӦҲӦ���ǿ��淴Ӧ����Ӧ�Ļ�ѧ����ʽΪSe��H2
SiO2��2H2O��(4)ͬ����Ԫ�ش��ϵ��·ǽ�������������S��H2��Ӧ��һ���ȡ����ڿ��淴Ӧ����Se��H2��ӦҲӦ���ǿ��淴Ӧ����Ӧ�Ļ�ѧ����ʽΪSe��H2 ![]() H2Se��(5)S��Oͬ���壬ԭ������S>O����ԭ�Ӱ뾶S>O��O��Fͬ���ڣ�ԭ������O<F����ԭ�Ӱ뾶O>F������ԭ�Ӱ뾶��S>O>F��
H2Se��(5)S��Oͬ���壬ԭ������S>O����ԭ�Ӱ뾶S>O��O��Fͬ���ڣ�ԭ������O<F����ԭ�Ӱ뾶O>F������ԭ�Ӱ뾶��S>O>F��
��5�����ڱ�ͬ���ڵĴ�������ԭ�Ӱ뾶��С��ͬ����Ԫ�ش������°뾶������

 �»����ܶ�Ա��ϵ�д�
�»����ܶ�Ա��ϵ�д� ����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�����Ŀ��һ�������£�H2O2��ˮ��Һ�з����ֽⷴӦ��2H2O2![]() 2H2O+O2����Ӧ�����У���ò�ͬʱ��H2O2�����ʵ���Ũ�����±���
2H2O+O2����Ӧ�����У���ò�ͬʱ��H2O2�����ʵ���Ũ�����±���
t/min | 0 | 20 | 40 | 60 | 80 |
c��H2O2��/molL��1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
�� H2O2�ķֽⷴӦ������ԭ��Ӧ����ǡ����ǡ�����
�ڸ÷ֽⷴӦ0��20min��ƽ����Ӧ����v��H2O2��ΪmolL��1 min��1 ��
�������Ӧ���õ�H2O2��ҺΪ100mL������O2g��
A��0.08 B��0.16 C��1.28 D��2.4��

