题目内容
Ⅰ、(1)下列实验操作或实验问题处理方法中,正确的是 (填序号)
![]()
A.不慎将酸溅到眼中,立即用水冲洗,边洗边眨眼睛
![]()
B.酒精灯洒漏少量酒精着火,用湿布盖灭
![]()
C.实验剩余的NaOH放回原试剂瓶
D.在容量瓶中加入一定体积的水再加入浓硫酸,配置准确浓度的稀硫酸
E.知趣乙酸乙酯时,加热前应先向试管中加入碎瓷片
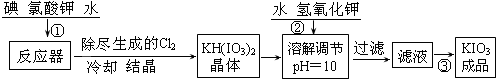
Ⅱ、无水氯化铝为白色粉末,极易吸水,常压下182.7℃升华。学生甲拟选用如下图所示仪器、装置(部分仪器连接的橡胶管或橡胶塞省略)和试剂制备无水氯化铝。

回答下列问题
(2)实验前,如何检查装置A的气密性 。
(3)装置A中反应的化学方程式为 。
(4)从上列仪器中选取制备无水氯化铝的装置,各装置的连接顺序为:
A→ → → → →G
(5)装置G的作用是
(6)学生乙提出另一种制备无水氯化铝的方案:将金属铝与足量盐酸反应后,将溶液加热蒸干、灼烧的到无水氯化铝。请你评价该方案是否可行,并说明理由
(1)A、B、E (3分)
(2)关闭分液漏斗的活塞,将管口接一段带玻璃管的乳胶管并放入盛水的水槽的水面下,用双手捂住烧瓶外壁一会儿,若导管口有气泡产生,松开双手后,导管内回升一段水柱,则证明气密性良好。或用止水夹封闭导管口,打开分液漏斗活塞和瓶盖,从中注水,漏斗端会形成一段水柱,一端时间后若水柱不动说明气密性良好。 (2分)
(3)MnO2 + 4 HCl (浓) ![]() MnCl2 + Cl2↑+ 2 H2O (2分)
MnCl2 + Cl2↑+ 2 H2O (2分)
(4)C、B、D、F (2分)
(5)吸收多余的氯气,同时防止空气中水蒸汽进入到装置F中使AlCl3水解。 (2分)
(6)不可行。 (1分)
AlCl3在水中存在如下平衡:AlCl3+3H2O



 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应实际通常是用溴化钠与一定浓度的硫酸和乙醇反应.某课外小组欲在实验室制备溴乙烷的装置如图,实验操怍步 骤如下:
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应实际通常是用溴化钠与一定浓度的硫酸和乙醇反应.某课外小组欲在实验室制备溴乙烷的装置如图,实验操怍步 骤如下: