题目内容
【题目】常温下将NaOH溶液添加到某二元弱酸H2A溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是( )

A.Ka2(H2A)的数量级为10-5B.NaHA溶液中c(H+)>c(OH-)
C.曲线M表示pH与![]() 的变化关系D.当混合溶液呈中性时:c (Na+) > c (HA-) > c (A2-)> c (OH-)=c (H+)
的变化关系D.当混合溶液呈中性时:c (Na+) > c (HA-) > c (A2-)> c (OH-)=c (H+)
【答案】B
【解析】
H2X为二元弱酸,以第一步电离为主,则Ka1(H2A)>Ka2(H2A),酸性条件下,则pH相同时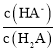 >
>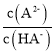 ,由图象可知N为
,由图象可知N为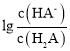 的变化曲线,M为
的变化曲线,M为 。
。
A.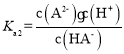 ,当
,当 =0时,
=0时,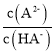 =1,此时pH≈5.4,则Ka2(H2A)≈10-5.4,可知Ka2(H2A)的数量级为10-6,故A错误;
=1,此时pH≈5.4,则Ka2(H2A)≈10-5.4,可知Ka2(H2A)的数量级为10-6,故A错误;
B.由图象可知, =0,即c(HA-)=c(A2-),此时pH≈5.4,可知HA-电离程度大于A2-水解程度,则NaHA溶液呈酸性,溶液中c(H+)>c(OH-),故B正确;
=0,即c(HA-)=c(A2-),此时pH≈5.4,可知HA-电离程度大于A2-水解程度,则NaHA溶液呈酸性,溶液中c(H+)>c(OH-),故B正确;
C.由以上分析可知曲线M表示pH与 的变化关系,故C错误;
的变化关系,故C错误;
D.由图象可知当pH=7时, >0,则c(A2-)>c(HA-),故D错误。
>0,则c(A2-)>c(HA-),故D错误。
故答案为B。

 名校课堂系列答案
名校课堂系列答案【题目】乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。
主反应:C4H10(g,正丁烷)![]() C2H4(g)+C2H6(g) ΔH1
C2H4(g)+C2H6(g) ΔH1
副反应:C4H10(g,正丁烷)![]() CH4(g)+C3H6(g) ΔH2 回答下列问题:
CH4(g)+C3H6(g) ΔH2 回答下列问题:
(1)化学上,将稳定单质的能量定为0,生成稳定化合物时的释放或吸收能量叫生成热,生成热可表示该物质相对能量。下表为25℃、101 kPa下几种有机物的生成热:
物质 | 甲烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
生成热/kJ·mol1 | 75 | 85 | 52 | 20 | 125 | 132 |
①表格中的物质,最稳定的是________________(填结构简式)。
②上述反应中,ΔH1=____________kJ·mol1。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。下列情况表明该反应达到平衡状态的是_________________(填代号)。
A.气体密度保持不变 B.![]() 保持不变
保持不变
C.反应热不变 D.正丁烷分解速率和乙烷消耗速率相等
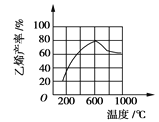
(3)向密闭容器中充入丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,
随着温度升高,乙烯产率降低,可能的原因是____________(填代号)。
A.平衡常数降低 B.活化能降低
C.催化剂活性降低 D.副产物增多
(4)在一定温度下向1 L恒容密闭容器中充入2 mol正丁烷,反应生成乙烯和乙烷,经过10 min 达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10 min内乙烷的生成速率v(C2H6)为___________mol·L1·min1。
②上述条件下,正丁烷的平衡转化率为_____________;该反应的平衡常数K为____。
(5)丁烷空气燃料电池以熔融的K2CO3(其中不含O2和HCO3-)为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e=6CO32-,负极反应式为____________________。