题目内容
由amolFe+bmolFe2O3组成的混和物,用足量的盐酸溶解。随着a/b的不同,反应产物各不相同。按照a/b的不同比值,结合有关氧化还原的反应竞争顺序,填写下列表格内容。表格可不填满,若不足可添加表格。
| a/b | 氧化还原反应主要产物 | 有关的离子方程式 |
| | | |
| | | |
| | | |
| | | |
| | | |
(14分,每个1分,)
| a/b | 氧化还原反应产物 | 有关的离子方程式 |
| a/b<1 | FeCl2 | Fe2O3+6H+=2Fe3++3H2O;2Fe3++Fe=3Fe2+ |
| a/b=1 | FeCl2 | Fe2O3+6H+=2Fe3++3H2O;2Fe3++Fe=3Fe2+ |
| a/b>1 | FeCl2 H2 | Fe2O3+6H+=2Fe3++3H2O;2Fe3++Fe=3Fe2+;Fe+2H+=Fe2++H2↑ |
本题所涉及到的常见氧化性离子的氧化性顺序为:Fe3+>H+;
当a=b时,Fe2O3+6H+=Fe3++3H2O,生成的Fe3+恰好被铁还原:2Fe3++Fe=3Fe2+;
当a>b时,铁过量,Fe2O3+6H+=Fe3++3H2O生成的Fe3+被部分铁还原:2Fe3++Fe=3Fe2+,余下的铁:Fe+2H+=Fe2++H2↑
当a<b时,铁不足,Fe2O3+6H+=Fe3++3H2O,生成的Fe3+被铁还原后仍有剩余:2Fe3++Fe=3Fe2+;
当a=b时,Fe2O3+6H+=Fe3++3H2O,生成的Fe3+恰好被铁还原:2Fe3++Fe=3Fe2+;
当a>b时,铁过量,Fe2O3+6H+=Fe3++3H2O生成的Fe3+被部分铁还原:2Fe3++Fe=3Fe2+,余下的铁:Fe+2H+=Fe2++H2↑
当a<b时,铁不足,Fe2O3+6H+=Fe3++3H2O,生成的Fe3+被铁还原后仍有剩余:2Fe3++Fe=3Fe2+;

练习册系列答案
相关题目
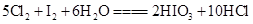 ,
,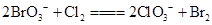 ,下列物质氧化性强弱顺序正确的是( )
,下列物质氧化性强弱顺序正确的是( )
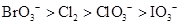
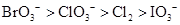

 e3+ > Cl2
e3+ > Cl2