题目内容
【题目】纯净干燥的氯气与熔融金属锡反应可制备SnCl4,某化学小组的同学设计了如下实验装置进行制备。
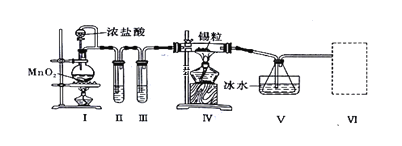
已知:①金属锡熔点为231℃,化学活泼性与铁相似;②SnCl4的沸点为114℃;③SnCl4易与水反应。
请根据上图装置回答:
(1)装置I中反应的离子方程式是________________________________________
(2)试管II中的试剂是________,试管III中的试剂是____________。
(3)装置V的作用是____________。
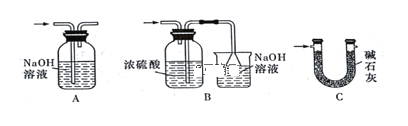
(4)裝置Ⅵ 最好选用下列装置中的________(填标号)。
(5)实验结束后,欲回收利用装置Ⅰ中未反应完的MnO2,需要的玻璃仪器有_________。
【答案】MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O 饱和食盐水 浓硫酸 冷凝(收集)SnCl4 C 漏斗、玻璃棒、烧杯
Mn2++Cl2↑+2H2O 饱和食盐水 浓硫酸 冷凝(收集)SnCl4 C 漏斗、玻璃棒、烧杯
【解析】
根据图及实验目的知,I是制备氯气的装置,加热条件下,浓盐酸和![]() 反应生成氯气;浓盐酸具有挥发性,气体亦可携带水蒸气,所以得到的氯气中含有
反应生成氯气;浓盐酸具有挥发性,气体亦可携带水蒸气,所以得到的氯气中含有![]() 、
、![]() 杂质;一般用饱和食盐水除去
杂质;一般用饱和食盐水除去![]() ,再用浓硫酸吸水,所以装置II中装有饱和食盐水吸收
,再用浓硫酸吸水,所以装置II中装有饱和食盐水吸收![]() ,装置III中装有浓硫酸干燥氯气;纯净的氯气与锡反应生成
,装置III中装有浓硫酸干燥氯气;纯净的氯气与锡反应生成![]() ,
,![]() 的沸点为114℃,沸点较低,所以装置V冰水浴降温,冷凝得到
的沸点为114℃,沸点较低,所以装置V冰水浴降温,冷凝得到![]() 液体。
液体。
(1)装置I是制备氯气的装置,加热条件下,浓盐酸和![]() 反应生成氯气,离子方程式为
反应生成氯气,离子方程式为![]() ,
,
故答案为:![]() ;
;
(2)装置II中装有饱和食盐水吸收![]() ;装置III中装有浓硫酸干燥氯气;
;装置III中装有浓硫酸干燥氯气;
故答案为:饱和食盐水;浓硫酸;
(3)![]() 的沸点较低,装置V中的冰水可以使得
的沸点较低,装置V中的冰水可以使得![]() 冷凝,得到
冷凝,得到![]() 液体,
液体,
故答案为:冷凝(收集)![]() ;
;
(4)氯气有毒,需要进行尾气处理,故装置VI应为尾气处理装置,吸收未反应完的氯气,![]() 易与水反应,所以不仅要除去氯气中的水蒸气,还要防止外界水蒸气进入,所以装置VI还要能防止水蒸气进入装置V,
易与水反应,所以不仅要除去氯气中的水蒸气,还要防止外界水蒸气进入,所以装置VI还要能防止水蒸气进入装置V,
A.氢氧化钠溶液可以吸收未反应完的氯气,但不能防止水蒸气进入装置Ⅴ,故A不选;
B.气体进入装置中导管应该长进短出,装置错误,故B不选;
C.碱石灰不仅可以吸收氯气,也可以吸收水蒸气和二氧化碳,能避免空气中二氧化碳和水蒸气进入装置Ⅴ,故C选;
故答案为:C;
(5)回收利用装置I中未反应完的![]() ,
,![]() 难溶于水,可以用过滤操作回收,过滤需要的仪器有: 漏斗、玻璃棒、烧杯,
难溶于水,可以用过滤操作回收,过滤需要的仪器有: 漏斗、玻璃棒、烧杯,
故答案为:漏斗、玻璃棒、烧杯。

【题目】I、在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量![]() N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
(1)写出该反应的热化学方程式_________________.
(2)已知H2O(l)═H2O(g);△H=+44kJ·mol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ.
(3)丙烷燃烧可以通过以下两种途径:途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣a kJ·mol﹣1;途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol﹣1;2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=﹣c kJ·mol﹣1;2H2(g)+O2 (g)═2H2O(l)△H=﹣d kJ·mol﹣1 (abcd均为正值)判断等量的丙烷通过两种途径放出的热量,途径I放出的热量_______(填“大于”、“等于”或“小于”)途径II放出的热量.
II、利用如图所示装置测定中和热的实验步骤如下:
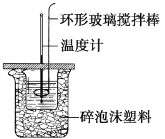
①用量筒量取50 mL 0.50 mol·L1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?__________________________。
(2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm3,又知中和反应后生成溶液的比热容c=4.18 J·g1·℃1。为了计算中和热,某学生实验记录数据如下:
实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | ||
1 | 20.0 | 20.0 | 23.0 |
2 | 20.1 | 20.1 | 23.2 |
3 | 20.1 | 20.1 | 24.2 |
4 | 20.2 | 20.2 | 23.4 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=____kJ·mol1_(结果保留一位小数)。
(3)不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_________________。
【题目】25 ℃时,部分物质的电离常数如下表所示:
化学式 | CH3COOH | H2C2O4 | H2S |
电离常数 | 1.8×10-5 | Ka1=5.4×10-2 Ka2=5.4×10-5 | Ka1=1.0×10-7 Ka2=7.1×10-15 |
请回答下列问题:
(1)若把CH3COOH、H2C2O4、HC2O4-、H2S、HS- 都看作是酸,其中酸性最弱的是________。
(2)CH3COOH、H2C2O4、H2S的酸性由强到弱的顺序为_____________________。
(3)NaHS溶液与NaHC2O4溶液反应的离子方程式为_______________。
(4)0.1 mol·L-1H2S溶液中c(H+)=________ mol·L-1。
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施