题目内容
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知: ![]()
![]()
则CO还原Fe2O3(s)的热化学方程式为________________________________。
(2)常温下,用氨水吸收CO2可得到NH4HCO3溶液。已知常温下:NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11。在NH4HCO3溶液中,c(NH4+)______c(HCO3-)(填“>”“<”或“=”),计算反应NH4+ + HCO3- + H2O NH3·H2O + H2CO3的平衡常数K=______________,物料守恒表达式为__________________________。
(3)以CO2为原料还可以合成多种物质。
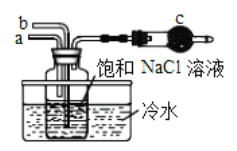
①如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。操作中先在_______处向饱和NaCl溶液中通入_________气体(填NH3或CO2),然后再在通入另一种气体。请写出反应的化学方程式_______________________。
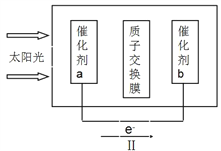
②人工光合作用能够借助太阳能用CO2和水制备化学原料,如图是通过人工光合作用制备HCOOH的原理示意图,请写出催化剂b处的电极反应式:____________________。
【答案】 ![]()
![]() > 1.25×10-3 c(NH4+)+c(NH3·H2O)=c(CO32-)+c(HCO3-)+c(H2CO3) a NH3 NaCl + CO2 + NH3 + H2O = NaHCO3 + NH4Cl
> 1.25×10-3 c(NH4+)+c(NH3·H2O)=c(CO32-)+c(HCO3-)+c(H2CO3) a NH3 NaCl + CO2 + NH3 + H2O = NaHCO3 + NH4Cl ![]()
【解析】(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=akJmol-1,②C(石墨)+CO2(g)=2CO(g)△H2=bkJmol-1,依据盖斯定律①-②×3得到热化学方程式为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=(a-3b) kJmol-1,故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=(a-3b) kJmol-1;
(2)根据NH3·H2O的电离平衡常数K=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11可知,铵根离子的水解程度小于碳酸氢根离子,因此c(NH4+)>c(HCO3-);反应NH4++HCO3-+H2O═NH3.H2O+H2CO3的平衡常数K=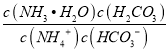 =
=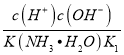 =
=![]() =1.25×10-3;NH4HCO3溶液中的物料守恒表达式为c(NH4+)+c(NH3·H2O)=c(CO32-)+c(HCO3-)+c(H2CO3),故答案为:>;1.25×10-3;c(NH4+)+c(NH3·H2O)=c(CO32-)+c(HCO3-)+c(H2CO3)。
=1.25×10-3;NH4HCO3溶液中的物料守恒表达式为c(NH4+)+c(NH3·H2O)=c(CO32-)+c(HCO3-)+c(H2CO3),故答案为:>;1.25×10-3;c(NH4+)+c(NH3·H2O)=c(CO32-)+c(HCO3-)+c(H2CO3)。
(3)①二氧化碳在水中的溶解度较小,氨气极易溶于水,因此实验时先向饱和氯化钠溶液中通入氨气,再通入二氧化碳,为了防止倒吸,应从a口通入氨气,b口通入二氧化碳,反应的方程式为NaCl + CO2 + NH3 + H2O = NaHCO3 + NH4Cl,故答案为:a;NH3;NaCl + CO2 + NH3 + H2O = NaHCO3 + NH4Cl;
②根据装置图中电子的流向,判断催化剂a为阳极电极反应:2H2O-4e-═O2+4H+,酸性增强;催化剂b为阴极,电极反应:CO2+2H++2e-═HCOOH,酸性减弱,总的电池反应为2H2O+2CO2═2HCOOH+O2,故答案为:CO2+2H++2e-═HCOOH;
