��Ŀ����
����Ŀ��ijʵ��С���һ����Al3+��δ֪��Һ���з�����������Һ��εμ�ijŨ��NaOH��Һ������NaOH��Һ�����mL����������������ʵ�����mol���Ĺ�ϵ����ͼ��ʾ������˵��������ǣ� �� 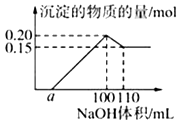
A.��δ֪��Һ�����ٺ���3��������
B.�μӵ�NaOH��Һ�����ʵ���Ũ��Ϊ5molL��1
C.�������ճ������ˡ�ϴ�ӡ����գ�������һ��Ϊ6 g
D.����Һ�н������ֽ��������ӣ�����һ������Ϊ���������ӣ���a=10
���𰸡�C
���������⣺A��ʵ����̷���������������������˵������H+ �� ������������������Һ���ɰ�ɫ����˵��һ��������������������˵����Һ�к���Al3+ �� �������������������Һ�������٣�ͼ�����˵����Һ�г��������ӣ�Ӧ������һ�ֽ��������ӣ���δ֪��Һ�����ٺ���3�������ӣ���A��ȷ��
B������ͼ������ܽ�������������ʵ���Ϊ0.20mol��0.15mol=0.05mol����������������Һ���=110mL��100mL=10mL���������Ƶ�Ũ��= ![]() =5mol/L����B��ȷ��
=5mol/L����B��ȷ��
C�����õ��ij�������ȷ����ɷ֣����Բ��ܼ������պ�õ������������������C����
D������һ��������Ϊ���۽��������ӣ���������������������0.05mol�����۽������ʵ���Ϊ0.15mol����ʼ���������������ΪamL�����������������ʵ���Ϊ0.05mol��3+0.15mol��2+a��10��3L��5mol/L=0.1L��5mol/L��a=10����D��ȷ��
��ѡC��

