题目内容
下列判断错误的是
A.沸点: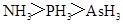 |
B.熔点: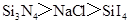 |
C.酸性: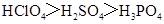 |
D.碱性: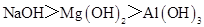 |
A
A、NH3分子间含有氢键,沸点最高,PH3和AsH3,都不含氢键,都为分子晶体,决定熔沸点高低的因素是分子间作用力,相对分子质量越大,分子间作用力越强,则熔沸点越高,PH3的相对分子质量最小,则沸点最低,A不正确;B、熔点:原子晶体>离子晶体>分子晶体,B正确;C、因P、S、Cl都在第三周期,同周期从左向右元素的非金属性增强,则非金属性Cl>S>P,由非金属性越强,则对应的最高价氧化物的水化物的酸性越强,所以HClO4的酸性最强,正确;D、Na、Mg、Al在同周期,同周期元素从左向右金属性在减弱,则金属性Na>Mg>Al,所以碱性最强的为NaOH,D正确;选A.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目