题目内容
(2011?焦作一模)用NA代表阿伏加德罗常数的值,下列叙述正确的是( )
分析:A、气体摩尔体积和气体体积换算物质的量结合分子式计算;
B、胶体粒子是氢氧化铁的集合体;
C、质量换算物质的量结合过氧化钠结构分析计算;
D、溶液体积未知,不能确定分子数;
B、胶体粒子是氢氧化铁的集合体;
C、质量换算物质的量结合过氧化钠结构分析计算;
D、溶液体积未知,不能确定分子数;
解答:解:A、标准状况下,22.4L的CO气体物质的量为1mol,含电子为14mol,1 mol N2所含的电子数14mol,故A正确;
B、将0.1molFeCl3水解制成胶体,所得胶体粒子是氢氧化铁的集合体,胶体粒子数小于0.1NA,故B错误;
C、7.8g过氧化钠物质的量为0.1mol,含0.2molNa+,含0.1molO22-;共计0.3mol,故C错误;
D、25℃时,1mol?L-1醋酸溶液中,溶液体积未知,所含CH3COOH分子总数不一定小于NA,故D错误;
故选A.
B、将0.1molFeCl3水解制成胶体,所得胶体粒子是氢氧化铁的集合体,胶体粒子数小于0.1NA,故B错误;
C、7.8g过氧化钠物质的量为0.1mol,含0.2molNa+,含0.1molO22-;共计0.3mol,故C错误;
D、25℃时,1mol?L-1醋酸溶液中,溶液体积未知,所含CH3COOH分子总数不一定小于NA,故D错误;
故选A.
点评:本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的条件应用,胶体粒子的组成,弱电解质电离平衡,关键过氧化钠的构成离子是钠离子和过氧根离子.

练习册系列答案
相关题目
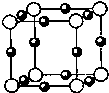 (2011?焦作一模)化学-选修物质结构与性质:
(2011?焦作一模)化学-选修物质结构与性质: