题目内容
18.下列转化过程需要加入还原剂的是( )| A. | Cu→Cu2+ | B. | CO32-→CO2 | C. | NH3→NO | D. | MnO4-→Mn2+ |
分析 转化过程需要加入还原剂才能实现,说明给予物质作氧化剂,在反应中得电子化合价降低,据此分析解答.
解答 解:A.Cu元素化合价由0价变为+2价,所以Cu是还原剂需要加入氧化剂才能实现,如浓硫酸、硝酸等,故A错误;
B.该反应中各元素化合价不变,所以不需要发生氧化还原反应就能实现,故B错误;
C.N元素化合价由-3价变为+2价,氨气是还原剂,需要氧化剂才能实现,如氧气等,故C错误;
D.Mn元素化合价由+7价变为+2价,则高锰酸根离子是氧化剂,需要还原剂才能实现,如浓盐酸等,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,侧重考查基本概念,明确元素化合价变化与氧化剂、还原剂关系是解本题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列溶液中,溶质的物质的量浓度为1mol•L-1的是( )
| A. | 将40g NaOH固体溶于1 L的水所形成的溶液 | |
| B. | 将22.4L NH3溶于水配成1 L的溶液 | |
| C. | 1L含1 mol K+的K2SO4溶液 | |
| D. | 将100mL0.5mol•L-1的NaNO3溶液加热蒸发掉一部分水,冷却至室温后得到50mL溶液 |
6.下列化学用语正确的是( )
| A. | 氯化钠的电子式: | |
| B. | 过氧化钠的化学式:Na2O | |
| C. | Cl-的结构示意图: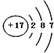 | |
| D. | 硫酸的电离方程式:H2SO4=2H++SO42- |
13.向Fe(OH)3 胶体中逐滴加入一种液体,先发生凝聚而沉淀,继续加入则沉淀消失,这种溶液是( )
| A. | 蒸馏水 | B. | 0.5 mol•L-1 H2SO4 | ||
| C. | 蔗糖溶液 | D. | 0.5 mol•L-1MgSO4 溶液 |
10.设 NA为阿伏加德罗常数的数值,下列说法中错误的是( )
| A. | 在标准状况下,22.4 L苯所含的碳原子数目为6NA | |
| B. | 常温常压下,6.2g氧化钠含有的离子数为0.3NA | |
| C. | 18 g 水所含的电子数目为10 NA | |
| D. | 3.2g O2、O3混合物中所含O原子一定是0.2NA |
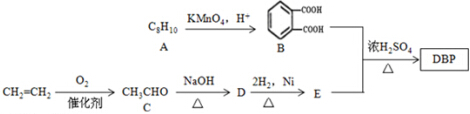

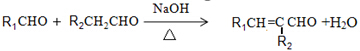
 .
. .
.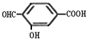 、
、 .
.