题目内容
【题目】工业上用铝土矿(主要成分为氧化铝,含少量氧化铁)制取铝的过程如图所示:
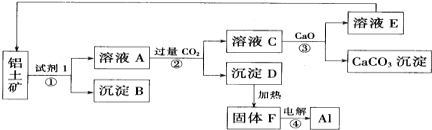
(1)试剂1为______(填化学式),①~④转化过程中_____消耗能量最多。
(2)沉淀B的化学式为______。
(3)电解F,当转移6mol电子时,可制得铝______ g。
(4)生产过程中,除物质E可以循环使用外,还可以循环使用的物质有______(填化学式)。
(5)写出离子方程式:①______, ② ______。
(6)写出化学方程式:④______。
【答案】(1)NaOH;④;(2)Fe2O3;(3)54;(4)CaO和CO2;(5)① Al2O3+2OH- =2AlO2-+ H2O
② CO2+AlO2-+2H2O=Al(OH) 3↓+HCO3- (6)2Al2O3![]() 4Al+3O2↑
4Al+3O2↑
【解析】
试题分析:(1)铝土矿(主要成分含氧化铝、氧化铁)加入氢氧化钠,氧化铁不和碱反应,氧化铝可与氢氧化钠反应生成偏铝酸钠和水;电解氧化铝需要破坏离子键,需要吸收大量的能量;
(2)铝土矿(主要成分含氧化铝、氧化铁)加入氢氧化钠,氧化铁不和碱反应,氧化铝可与氢氧化钠反应生成偏铝酸钠和水;过滤后得到的沉淀为氧化铁;
(3)电解氧化铝的方程式为2Al2O3![]() 4Al+3O2↑,设得到铝的质量为x,
4Al+3O2↑,设得到铝的质量为x,
2Al2O3![]() 4Al+3O2↑ 转移电子
4Al+3O2↑ 转移电子
108g 12mol
x 6mol
解得x=54g;
(4)煅烧碳酸钙得到CaO和CO2,B生成沉淀需要二氧化碳、碳酸钠转化为碳酸钙需要CaO,所以CaO和CO2能循环利用;
(5)偏铝酸钠溶液通入过量的二氧化碳反应生成氢氧化铝和碳酸氢钠,离子方程式为CO2+AlO2-+2H2O=Al(OH) 3↓+HCO3-;
(6)电解熔融氧化铝的方程式为2Al2O3![]() 4Al+3O2↑。
4Al+3O2↑。