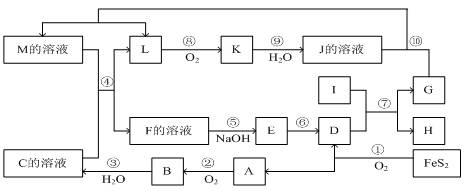
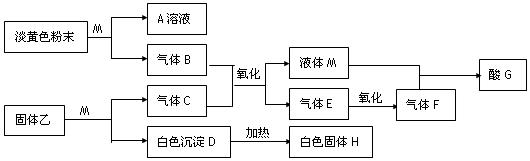
题目内容
(10分)W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。依据下列信息回答相关问题:
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为 。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为 。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(4)比较Y、Z气态氢化物的稳 定性: > (用分子式表示)。
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是: > > > 。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为 。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为 。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(4)比较Y、Z气态氢化物的稳 定性: > (用分子式表示)。
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是: > > > 。
(1)Al(OH)3+OH-=AlO2-+2H2O (2)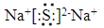
(3)SO2+Cl2+2H2O=H2SO4+2HCl (4)HCl>H2S。
(5)S2->Cl >Na+>Al3+ 。
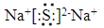
(3)SO2+Cl2+2H2O=H2SO4+2HCl (4)HCl>H2S。
(5)S2->Cl >Na+>Al3+ 。
(1)W、X是金属元素,且W、X各自的最高价氧化物对应的水化物可以反应生盐和水,所以X是铝,W是钠,反应的方程式为Al(OH)3+OH-=AlO2-+2H2O。
(2)W与Y 可形成化合物W2Y,因此Y是S,Na2S是含有离子键的离子化合物,电子式
为 。
。
(3)Y是S,所以Z是Cl,氯的非金属性强于S的,所以氯气能氧化SO2,方程式为SO2+Cl2+2H2O=H2SO4+2HCl 。
(4)非金属性越强,相应氢化物的稳定性越强,所以氯化氢的稳定性强于硫化氢的。
(5)核外电子排布相同的微粒,其微粒半径所原子序数的增大而减小,因此四种元素简单离子的离子半径由大到小的顺序是S2->Cl >Na+>Al3+ 。
(2)W与Y 可形成化合物W2Y,因此Y是S,Na2S是含有离子键的离子化合物,电子式
为
 。
。(3)Y是S,所以Z是Cl,氯的非金属性强于S的,所以氯气能氧化SO2,方程式为SO2+Cl2+2H2O=H2SO4+2HCl 。
(4)非金属性越强,相应氢化物的稳定性越强,所以氯化氢的稳定性强于硫化氢的。
(5)核外电子排布相同的微粒,其微粒半径所原子序数的增大而减小,因此四种元素简单离子的离子半径由大到小的顺序是S2->Cl >Na+>Al3+ 。

练习册系列答案
相关题目