题目内容
在10 L密闭容器中,1 mol A和3
mol B在一定条件下反应:A(气)+xB(气)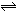 2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是
2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是
A.平衡时,物质的量比A∶B∶C=2∶11∶4 B.x值等于4
C.B的平均反应速率为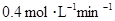 D.A的转化率20%
D.A的转化率20%
【答案】
AC
【解析】考查可逆反应的有关计算。
A(气)+xB(气)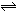 2C(气)
2C(气)
起始量(mol) 1 3 0
转化量(mol) 0.2 0.2x 0.4
平衡量(mol) 0.8 3-0.2x 0.4
所以有0.8+3-0.2x+0.4=3.4
解得x=4
所以平衡时,物质的量比A∶B∶C=4∶11∶2,A不正确,B正确。B的平均反应速率为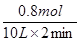 =
=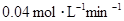 ,C不正确。A的转化率是0.2÷1×100%=20%,D正确,答案选AC。
,C不正确。A的转化率是0.2÷1×100%=20%,D正确,答案选AC。

练习册系列答案
相关题目
反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率v(X)(反应物的消耗速率或生成物的生成速率)可表示为
4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率v(X)(反应物的消耗速率或生成物的生成速率)可表示为
| A.v(NH3)=0.010 mol·(L·s)-1 | B.v(O2)=0.001 mol·(L·s)-1 |
| C.v(NO)=0.0010 mol·(L·s)-1 | D.v(H2O)=0.045 mol·(L·s)-1 |
 4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45
mol,则此反应的平均速率v(X)(反应物的消耗速率或生成物的生成速率)可表示为( )
4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45
mol,则此反应的平均速率v(X)(反应物的消耗速率或生成物的生成速率)可表示为( ) 4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45
mol,则此反应的平均反应速率v(X)(反应物的消耗速率或产物的生成速率)可表示为
4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45
mol,则此反应的平均反应速率v(X)(反应物的消耗速率或产物的生成速率)可表示为 4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均反应速率v(X)(反应物的消耗速率或产物的生成速率)可表示为
4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均反应速率v(X)(反应物的消耗速率或产物的生成速率)可表示为