题目内容
将一定质量的Na2CO3和NaHCO3混合物灼烧至恒重,将放出的气体通入足量的Ca(OH)2饱和溶液中,充分反应后得到的沉淀的质量是1.0g, 加热后剩余的固体物质与足量的稀盐酸反应,收集到2.2g气体,计算原固体混合物中Na2CO3与NaHCO3的质量。(答案保留到小数点后一位)。
加热后剩余的固体物质与足量的稀盐酸反应,收集到2.2g气体,计算原固体混合物中Na2CO3与NaHCO3的质量。(答案保留到小数点后一位)。
 加热后剩余的固体物质与足量的稀盐酸反应,收集到2.2g气体,计算原固体混合物中Na2CO3与NaHCO3的质量。(答案保留到小数点后一位)。
加热后剩余的固体物质与足量的稀盐酸反应,收集到2.2g气体,计算原固体混合物中Na2CO3与NaHCO3的质量。(答案保留到小数点后一位)。1.68g 4.24g
解:设NaHCO3质量为X,Na2CO3质量为Y,依题意得
2NaHCO3 = Na2CO3 + H2O + CO2↑
168 106 44
44
X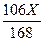
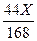
Na2CO3 + 2HCl =" 2NaCl" + H2O + CO2↑
106 44
44
Y +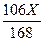 2.2 g
2.2 g
CO2 + Ca(OH)2 = CaCO3↓+ H2O

2NaHCO3 = Na2CO3 + H2O + CO2↑
168 106
 44
44X
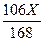
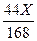
Na2CO3 + 2HCl =" 2NaCl" + H2O + CO2↑
106
 44
44Y +
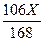 2.2 g
2.2 gCO2 + Ca(OH)2 = CaCO3↓+ H2O


练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案
相关题目
 Na++OH-
Na++OH-