题目内容
【题目】A是一种红棕色金属氧化物,B、D是金属单质。
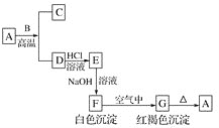
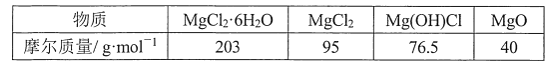
(1)写出下列物质的化学式:A________、E________、F________、G________。
(2)按要求写方程式:
①A+B→C+D的化学方程式:_________________________________;
②F→G的化学方程式:________________________________________________;
③E→F的离子方程式:________________________________________。
【答案】Fe2O3 FeCl2 Fe(OH)2 Fe(OH)3 2Al+Fe2O3![]() 2Fe+Al2O3 4Fe(OH)2+O2+2H2O===4Fe(OH)3 Fe2++2OH-===Fe(OH)2↓
2Fe+Al2O3 4Fe(OH)2+O2+2H2O===4Fe(OH)3 Fe2++2OH-===Fe(OH)2↓
【解析】
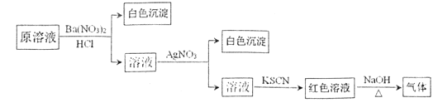
A是一种红棕色金属氧化物,则A是Fe2O3,B、D是金属单质,A和B在高温下能反应生成金属单质D,则该反应是铝热反应,B是Al,D是Fe,C是Al2O3, G是红褐色沉淀,分解生成氧化铁,则G是Fe(OH)3,F是Fe(OH)2,铁和盐酸反应生成氯化亚铁和氢气,E和氢氧化钠溶液反应生成Fe(OH)2,则E是FeCl2,结合物质的性质分析解答.
(1)通过以上分析知,A、E、F、G分别是:Fe2O3、FeCl2、Fe(OH)2、Fe(OH)3,
故答案为:Fe2O3;FeCl2;Fe(OH)2;Fe(OH)3;
(2)①A是氧化铁,B是铝,二者在高温下发生铝热反应生成铁和氧化铝,反应方程式为:2Al+Fe2O3![]() 2Fe+Al2O3 ,故答案为:2Al+Fe2O3
2Fe+Al2O3 ,故答案为:2Al+Fe2O3![]() 2Fe+Al2O3 ;
2Fe+Al2O3 ;
②F是氢氧化亚铁,氢氧化亚铁不稳定,易被空气中氧气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③E是氯化亚铁溶液,与氢氧化钠溶液反应生成氢氧化亚铁和氯化钠,故离子方程式是Fe2++2OH-===Fe(OH)2↓;
故答案为:Fe2++2OH-===Fe(OH)2↓。

【题目】化学与社会、生活密切相关,对下列现象或事实的解释不正确的是( )
选项 | 现象或事实 | 解释或对应的离子方程式 |
A | 用热的纯碱溶液洗去油污 | CO32-+H2O 溶液呈碱性,温度升高碱性增强 |
B | 酸雨样品在空气中放置pH减小 | SO2+H2O=H2SO3 |
C | 用泡沫灭火器灭火 | Al3++3HCO3-=Al(OH)3↓+3CO2↑ |
D | 用加热法除去NaCl固体中混有的NH4Cl固体 | NH4Cl固体在加热条件下可以完全分解成为气体而除去 |
A.AB.BC.CD.D