题目内容
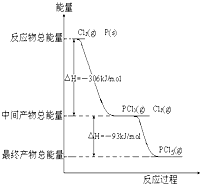
(10分)红磷 P (s)和 Cl2(g)发生反应生成 PCl3(g)和PCl5(g)。如图所示(图中的△H表示生成 l mol 产物的数据)。
根据上图回答下列问题:
(1)P和CI2反应生成 PC13 的热化学方程式是______________________________;
(2)PC15分解成 PC13 和 Cl2的热化学方程式是_____________________________;上述分解反应是一个可逆反应。温度 Tl 时,在密闭容器中加人 0.80 mol PC15,反应达平衡时 PC15 还剩 0.60mol ,其分解率 al 等于_________________;若反应温度由 Tl 升高到T2,平衡时 PC15 的分解率为a2,a2_________ al (填“大于”、“小于”或“等于”);
(3)工业上制备 PC15 通常分两步进行,先将 P 和 C12 反应生成中间产物 PC13 ,然后降温,再和Cl2 反应生成 PCl5 。原因是___________________________________
______________________________________________________;
(4)P和 C12 分两步反应生成 1 molPC15 的△H3==__________________,一步反应生成 1 molPC15 的△H4____________△H3(填“大于”、“小于”或“等于”)。
(5)PC15与足量水充分反应,最终生成两种酸,其化学方程式是
______________________________________________________________________。
(1)2P(s) + 3Cl2(g)=2PCl3(g);△H =-612kJ/mol
(2)PCl5(g)=PCl3(g) + Cl2(g);△H=+93kJ/mol 25% 大于
(3) 两步反应都是放热反应,降温有利于提高产率,防止产物分解
(4) -399kJ/mol 等于
(5)PCl5+ 4H2O=H3PO4 +5HCl
解析:根据图示数据可以判断P和CI2生成 PC13为放热反应,而PC15分解成PC13和Cl2为吸热反应,并可写出对应热化学方程式,2P(s) + 3Cl2(g)=2PCl3(g);△H =-612kJ/mol PCl5(g)=PCl3(g) + Cl2(g);△H= +93kJ/mol;反应的PCl5是0.8-0.6=0.2mol转化率可以求得为25%,由于PC15分解反应为吸热反应,升温分解率增大;由图示数据可知,P→PCl3和PCl3→PCl5的反应都是放热反应,降温有利于提高产率,防止产物分解,故工业上制备 PC15 通常分两步进行。根据盖斯定律可以求得△H3=△H1+△H2=-399kJ/mol。PC15与足量水反应,相当于水解,最终得到H3PO4 和HCl两种酸。

 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图判断,下列叙述正确的是( )
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图判断,下列叙述正确的是( )| A、P和Cl2分两步反应生成1molPCl5的△H3=399 kJ?mol-1 | ||
| B、P和Cl2一步反应生成1molPCl5的△H4<△H3 | ||
C、P和Cl2反应生成PCl3的热化学方程式为:P(s)+
| ||
| D、PCl5分解成PCl3和Cl2的热化学方程式为:PCl5(g)=PCl3(g)+Cl2(g)△H=93kJ?mol-1 |

 红磷P(s)和Cl2(g)之间的反应为①P(s)+
红磷P(s)和Cl2(g)之间的反应为①P(s)+