题目内容
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,1.12L CCl4含有的共价键数为0.2NA
B. 常温常压下,2.3g NO2和N2O4的混合物中含有的氧原子数为0.2NA
C. 过氧化钠与水反应时,生成0.lmol氧气转移的电子数为0.2NA
D. 常温下,0.1mol·L-1溶液中阴离子总数大于0.1NA
练习册系列答案
相关题目
苯甲酸乙酯可用作食用香料。某小组用如下装置制备苯甲酸乙酯
反应原理: (苯甲酸乙酯)+H2O
(苯甲酸乙酯)+H2O
产物和部分反应物相关数据如下:
物质 | 苯甲酸 | 乙醇 | 苯甲酸乙酯 |
熔点/℃ | 122.1 | -117.3 | -34.6 |
沸点/℃ | 249 | 78.3 | 213 |

实验步骤:
①在B中加入的物质有:12.2g苯甲酸、10mL乙醇、10mL浓硫酸和沸石;
②按图甲安装好仪器,水浴加热,回流2小时;
③冷却后将B中液体与30mL水混合,并分批加入碳酸钠粉末;
④分液,取出有机层并加入适量MgSO4摇匀;
⑤按图乙装置安好仪器,加热精馏④所得有机物,收集产品。
回答下列问题:
(1)仪器C的名称______________。
(2)步骤① 若加热后才发现未加沸石,应采取的措施是________;步骤② 采取水浴加热的优点是______。
(3)步骤③ 为了预防液体因瞬时放出大量热而飞溅,将有机物与水混合的操作是____________。
(4)步骤④分液时除了要用到烧杯,还需要的主要玻璃仪器有__________,使用该仪器之前需要进行的操作是__________;无水MgSO4的作用是___________。
(5)步骤⑤收集馏分应控制的最佳温度为____________。
(6)为了提高苯甲酸乙酯的产率,可以采取的措施_________(任填一种)。





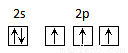

 CH3OH(g) △H1=-90.0 kJ• mol-1
CH3OH(g) △H1=-90.0 kJ• mol-1

 D. 5项
D. 5项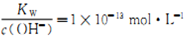 的溶液中:Na+、K+、AlO2-、NO3-
的溶液中:Na+、K+、AlO2-、NO3-