题目内容
《化学与生活》模块(Ⅰ)NO分子因污染空气而臭名昭著.近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究的热点,NO亦被称为“明星分子”.请回答下列问题.
(1)NO对环境的危害在于
A.破坏臭氧层 B.高温下能使一些金属氧化
C.造成酸雨 D.与人体血红蛋白结合
(2)在含Cu+离子的酶的活化中心中,亚硝酸根离子可转化为NO.写出Cu+和亚硝酸根
离子在酸性水溶液中反应的离子方式:
(Ⅱ) 市场上出售的热敷袋,其主要成分是铁屑、炭粉、木屑及少量NaCl、H2O等.它在使用之前,需要塑料袋与空气隔绝;使用时开启塑料袋上的小孔,轻轻揉搓就会放出热量来;当使用完后还会发现有铁锈生成.根据上述现象回答:
(1)热敷袋产生的热量是利用铁发生了
(2)炭粉的主要作用是
(3)加入NaCl的作用是
(4)试写出有关电极反应:
负极
正极
分析:(Ⅰ)、(1)根据NO的性质可知,NO易与氧气结合,氮的氧化物易形成酸雨;
(2)酸性条件下,亚硝酸根离子和亚铜离子反应生成铜离子、NO和水;
(Ⅱ)(1)热敷袋产生的热量的反应原理是发生电化学反应,Fe为负极被氧化;
(2)金属铁是碳粉构成的原电池中,碳粉为电池的正极;
(3)金属铁是碳粉构成的原电池中,氯化钠可以作为电解质溶液;
(4)根据金属的吸氧腐蚀原理来书写电极反应以及电池反应.
(2)酸性条件下,亚硝酸根离子和亚铜离子反应生成铜离子、NO和水;
(Ⅱ)(1)热敷袋产生的热量的反应原理是发生电化学反应,Fe为负极被氧化;
(2)金属铁是碳粉构成的原电池中,碳粉为电池的正极;
(3)金属铁是碳粉构成的原电池中,氯化钠可以作为电解质溶液;
(4)根据金属的吸氧腐蚀原理来书写电极反应以及电池反应.
解答:解:(Ⅰ)、(1)因NO易与氧气结合,氮的氧化物、二氧化硫是形成酸雨的成分,所以NO易形成酸雨,NO能与臭氧反应而破坏臭氧层,则A、C、D正确,而只有高温时才可氧化金属,所以B不正确,故答案为:ACD;
(2)酸性条件下,亚硝酸根离子具有氧化性、亚铜离子具有还原性,所以亚硝酸根离子和亚铜离子反应生成铜离子、NO和水,离子反应方程式为:Cu++NO2-+2H+═Cu2++NO↑+H2O,
故答案为:Cu++NO2-+2H+═Cu2++NO↑+H2O;
(Ⅱ)、(1)铁的活泼性大于碳的,在构成的原电池中,铁作负极,铁失去电子被氧化,故答案为:氧化;
(2)碳粉和铁活泼性不同,且都导电;氯化钠是强电解质,易溶于水;碳粉、铁、氯化钠溶液构成了原电池,碳的活泼性比铁小,所以作正极,因为形成原电池,从而加速铁的氧化,故答案为:与铁粉、氯化钠溶液构成原电池,加速铁的氧化;
(3)氯化钠是强电解质,易溶于水,溶于水后得到电解质溶液,故答案为:氯化钠溶于水形成电解质溶液,加速铁被氧化;
(4)铁的活泼性大于碳的,在构成的原电池中,铁作负极,铁失去电子被氧化,所以负极反应是:Fe-2e-═Fe2+,正极上是氧气发生得电子的还原反应,即O2+2H2O+4e-═4OH-,故答案为:Fe-2e-═Fe2+;O2+2H2O+4e-═4OH-.
(2)酸性条件下,亚硝酸根离子具有氧化性、亚铜离子具有还原性,所以亚硝酸根离子和亚铜离子反应生成铜离子、NO和水,离子反应方程式为:Cu++NO2-+2H+═Cu2++NO↑+H2O,
故答案为:Cu++NO2-+2H+═Cu2++NO↑+H2O;
(Ⅱ)、(1)铁的活泼性大于碳的,在构成的原电池中,铁作负极,铁失去电子被氧化,故答案为:氧化;
(2)碳粉和铁活泼性不同,且都导电;氯化钠是强电解质,易溶于水;碳粉、铁、氯化钠溶液构成了原电池,碳的活泼性比铁小,所以作正极,因为形成原电池,从而加速铁的氧化,故答案为:与铁粉、氯化钠溶液构成原电池,加速铁的氧化;
(3)氯化钠是强电解质,易溶于水,溶于水后得到电解质溶液,故答案为:氯化钠溶于水形成电解质溶液,加速铁被氧化;
(4)铁的活泼性大于碳的,在构成的原电池中,铁作负极,铁失去电子被氧化,所以负极反应是:Fe-2e-═Fe2+,正极上是氧气发生得电子的还原反应,即O2+2H2O+4e-═4OH-,故答案为:Fe-2e-═Fe2+;O2+2H2O+4e-═4OH-.
点评:本题考查电化学、氮的化合物性质知识,题目难度不大,注意形成原电池的条件以及工作原理.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目



 和
和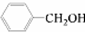 ,应选用
,应选用