题目内容
18.如图物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如图所示的转化.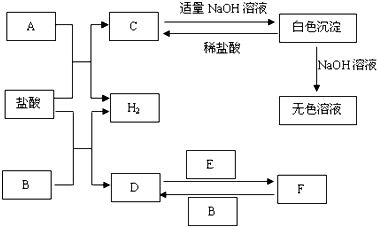
试回答下列问题:
(1)写出无色溶液中溶质的化学式:NaAlO2;写出E的电子式
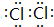 .
.(2)写出C到白色沉淀的化学方程式是AlCl3+3NaOH=Al(OH)3↓+3NaCl.
(3)反应F→D的离子方程式是2Fe3++Fe=3Fe2+.
分析 单质A与盐酸反应得到C与氢气,C与NaOH反应得到白色沉淀,且白色沉淀能溶于NaOH溶液与稀盐酸,则A为Al、C为AlCl3、白色沉淀为Al(OH)3,无色溶液为NaAlO2溶液.E在常温下是黄绿色气体,则E为Cl2,B是常见的金属,与盐酸反应生成D,D能被氯气氧化生成F,F能与金属反应生成D,则B为变价金属,可推知B为Fe,D为FeCl2,F为FeCl3,据此解答.
解答 解:单质A与盐酸反应得到C与氢气,C与NaOH反应得到白色沉淀,且白色沉淀能溶于NaOH溶液与稀盐酸,则A为Al、C为AlCl3、白色沉淀为Al(OH)3,无色溶液为NaAlO2溶液.E在常温下是黄绿色气体,则E为Cl2,B是常见的金属,与盐酸反应生成D,D能被氯气氧化生成F,F能与金属反应生成D,则B为变价金属,可推知B为Fe,D为FeCl2,F为FeCl3.
(1)写出无色溶液中溶质的化学式为NaAlO2;E为Cl2,电子式为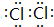 ,故答案为:NaAlO2;
,故答案为:NaAlO2;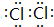 ;
;
(2)C到白色沉淀的化学方程式是AlCl3+3NaOH=Al(OH)3↓+3NaCl,故答案为:AlCl3+3NaOH=Al(OH)3↓+3NaCl;
(3)反应F→D的离子方程式是2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+.
点评 本题考查无机物的推断,涉及Fe、Al、Cl元素单质化合物的性质,E的颜色、白色沉淀的特殊反应、D与F之间转化是推断突破口,难度中等,注意对基础知识的掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列有关物质的鉴别方法正确的是( )
| A. | 在进行焰色反应时,透过蓝色钴玻璃看到紫色火焰,证明含K+,不含Na+ | |
| B. | 向某无色溶液中加入稀盐酸无现象,再加入BaCl2溶液产生白色沉淀,证明含SO42ˉ | |
| C. | 向某无色溶液中加入稀盐酸后,再加入AgNO3溶液,产生白色沉淀,证明含Clˉ | |
| D. | 向某无色溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的气体,证明含CO32ˉ |
9.CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol
反应过程中测定的部分数据如下表:
(1)反应0~2min末的平均速率v(COCl2)=0.1mol/(L?min).
(2)在2min~4min间,v(Cl2)正=v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=5.
(3)在表格中画出0~4min末n(COCl2)随时间的变化示意图图2
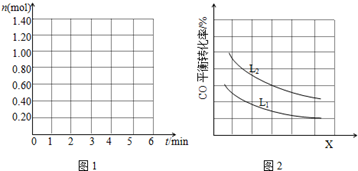
(4)已知X、L可分别代表温度或压强,如图2表示L一定时,CO的转化率随X的变化关系.X代表的物理量是温度;a<0 (填“>”,“=”,“<”),依据是因为X增大时,CO的平衡转化率降低,平衡逆向移动.
反应过程中测定的部分数据如下表:
| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
(2)在2min~4min间,v(Cl2)正=v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=5.
(3)在表格中画出0~4min末n(COCl2)随时间的变化示意图图2

(4)已知X、L可分别代表温度或压强,如图2表示L一定时,CO的转化率随X的变化关系.X代表的物理量是温度;a<0 (填“>”,“=”,“<”),依据是因为X增大时,CO的平衡转化率降低,平衡逆向移动.
13.食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质.已知:
请回答下列问题:
(1)定温度下,向0.1mol•L-1 CH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是ad(填代号).
a.溶液的pH增大 b.CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH- ).c(H+ )不变
(2)25℃时,0.10mol•L-1Na2CO3 溶液的pH=11,则溶液中由水电离出的c(OH-):10-3 mol•L-1.
(3)常温下,将20mL 0.10mol•L-1CH3COOH溶液和20mL 0.10mol•L-1HNO2 溶液分别与20mL 0.10mol•L-1NaHCO3 溶液混合(混合后溶液体积变化忽略不计).
①反应开始时,v(CH3COOH)<v(HNO2)(填“>”、“<”或“:”),原因是K(HNO2)>K(CH3COOH),说明HNO2 的酸性强,等物质的量浓度的HNO2 溶液和CH3COOH溶液相 比较,HNO2 溶液的c(H+)大,与NaHCO3 溶液的反应速率较快.
②充分反应后.两溶液中c(CH3COO-)<c(NO2-)(填“>”、“<”或“=”).
(4)25°C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18.
| 弱酸 | CH3COOH | H2CO3 | HNO2 |
| 电离常数(25℃) | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K=5.0×10-4 |
(1)定温度下,向0.1mol•L-1 CH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是ad(填代号).
a.溶液的pH增大 b.CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH- ).c(H+ )不变
(2)25℃时,0.10mol•L-1Na2CO3 溶液的pH=11,则溶液中由水电离出的c(OH-):10-3 mol•L-1.
(3)常温下,将20mL 0.10mol•L-1CH3COOH溶液和20mL 0.10mol•L-1HNO2 溶液分别与20mL 0.10mol•L-1NaHCO3 溶液混合(混合后溶液体积变化忽略不计).
①反应开始时,v(CH3COOH)<v(HNO2)(填“>”、“<”或“:”),原因是K(HNO2)>K(CH3COOH),说明HNO2 的酸性强,等物质的量浓度的HNO2 溶液和CH3COOH溶液相 比较,HNO2 溶液的c(H+)大,与NaHCO3 溶液的反应速率较快.
②充分反应后.两溶液中c(CH3COO-)<c(NO2-)(填“>”、“<”或“=”).
(4)25°C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18.
6.下列有关热化学方程式的叙述正确的是( )
| A. | 已知S(单斜,s)=S(正交,s)△H<0,则单斜硫比正交硫稳定 | |
| B. | HCl和NaOH反应的中加热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| C. | 已知S(g)+O2(g)═SO2(g)△H1<0;S(s)+O2(g)═SO2(g)△H2<0 则△H1<△H2 | |
| D. | 下列反应中,反应物的总能量E1与生成物的总能量E2一定相等$\stackrel{A+B}{反应物总能量{E}_{1}}$$\stackrel{发生反应A+B=C+D}{→}$$\stackrel{C+D}{生成物总能量{E}_{2}}$ |
7.下列离子方程式书写正确的是( )
| A. | 实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| B. | 向NaHSO4溶液中滴加Ba(OH)2溶液至碱性:SO42-+2H++Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | NH4Cl浓溶液中滴加浓NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
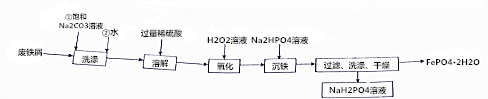
 ;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-.
;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-.