题目内容
已知NH4CuSO3与足量的3 mol/L硫酸混合微热,产生下列现象:①有红色金属生成;②产生刺激性气味的气体;③溶液呈现蓝色。据此判断下列说法正确的是
A.反应中硫酸作氧化剂 B.NH4CuSO3中硫元素被氧化
C.刺激性气味的气体是氨气 D.1mol NH4CuSO3完全反应转移0.5 mol电子
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案A~F六种元素中,除F外其他均为短周期元素,它们的原子结构或性质如下表所示。
元素 | 原子结构或性质 |
A | 其形成的一种同位素原子在考古中可推测化石的年代 |
B | 与A同周期,其最高价氧化物的水化物无论浓、稀溶液均有强氧化性 |
C | 地壳中含量最多的元素 |
D | D原子的内层电子数是最外层电子数的5倍 |
E | 其单质主要存在于火山口附近 |
F | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
请回答下列问题:
(1)A在元素周期表中的位置是_______________;A与C形成的化合物AC2的电子式是__________。
(2) 下列事实能证明C和E的非金属性强弱的是 。(填序号)
①常温下,C的单质呈气态,E的单质呈固态
②C的气态氢化物的稳定性强于E的气态氢化物的稳定性
③C与E形成的化合物中,E呈正价
④E的氢化物的沸点高于C的氢化物的沸点
(3) 由A、B、C和氢元素四种元素所形成的阴、阳离子数目之比为1:1的离子化合物是 (填化学式),它与足量NaOH溶液在加热时反应的离子方程为: 。
(4) FC与足量B的最高价氧化物的水化物的稀溶液反应的离子方程式 。若有标准状况下5.6L的BC生成,则转移的电子数为 。
(5) A的氢化物有多种,1 mol A的某种氢化物分子中含有14 mol电子,已知在25℃、101kPa下,1g该氢化物在足量氧气中完全燃烧生成液态水时放出的热量为40 kJ,写出表示该氢化物燃烧热的热化学方程式: 。


 完全转化为NH3逸出,另取一份加入含bmolHCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为
完全转化为NH3逸出,另取一份加入含bmolHCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为 mol/L D.
mol/L D.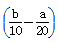 mol/L
mol/L
 液中:
液中: 、Na+、AlO2-、NO3-、S2-、
、Na+、AlO2-、NO3-、S2-、

 Cl-、K+、
Cl-、K+、
