题目内容
【题目】某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置:
(1)实验室常用装置E制备Cl2 , 指出该反应中浓盐酸所表现出的性质 ,
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为:
B D
(3)装置C的作用是
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅,试根据该实验装置和两名同学的实验结果
①指出在气体进入品红溶液之前,先将SO2和Cl2通过浓硫酸的两个目的 、 .
②试分析甲同学实验过程中,品红溶液不褪色的原因是: 、 ,并用离子方程式表示
③你认为乙同学是怎样做到让品红溶液变得越来越浅的? .
【答案】还原性;酸性;溶液由无色变成红色;溶液没有明显变化;吸收多余的SO2和Cl2 , 防止污染环境;使SO2和Cl2混合均匀,通过观察气泡控制气体的流速;使SO2和Cl2混合均匀,通过观察气泡控制气体的流速;控制SO2和Cl2按物质的量之比1:1进气,二者发生反应;生成无漂白性的H2SO4和HCl;SO2+Cl2+2H2O=SO42﹣+2Cl﹣+4H+;控制SO2和Cl2进气的物质的量,使之不相等
【解析】(1)实验室制取氯气的反应方程式为:MnO2+4HCl![]() MnCl2+Cl2↑+2H2O,由HCl生成MnCl2 , 氯元素化合价不变,
MnCl2+Cl2↑+2H2O,由HCl生成MnCl2 , 氯元素化合价不变,
由HCl生成Cl2 , 氯元素化合价升高,所以浓盐酸所表现出的性质是酸性和还原性.
所以答案是:还原性和酸性.
(2)次氯酸的漂白性是利用次氯酸的强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质生成无色物质,次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的;加热时,次氯酸漂白过的溶液无变化,二氧化硫和有色物质生成的无色物质不稳定,加热时能重新变成红色.
所以答案是:溶液由无色变成红色;溶液没有明显变化.
(3)氯气和二氧化硫有毒,不能排放到空气中,但氯气和二氧化硫都和碱反应,所以装置C的作用是保证安全,吸收多余的氯气和二氧化硫.
所以答案是:吸收多余的SO2和Cl2 , 防止污染环境.
(4)①浓硫酸和二氧化硫、氯气不反应,但氯气和二氧化硫在该装置中能充分混合,且通过观察气泡的速度控制气体流量,使二者按一定比列混合.
所以答案是:使SO2和Cl2混合均匀,通过观察气泡控制气体的流速.
②氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应而使气体失去漂白性,离子反应方程式为SO2+Cl2+2H2O═4H++SO42﹣+2Cl﹣ .
所以答案是:控制SO2和Cl2按物质的量之比1:1进气,二者发生反应,生成无漂白性的H2SO4和HCl,SO2+Cl2+2H2O=SO42﹣+2Cl﹣+4H+ .
③通气一段时间后,品红溶液颜色随时间推移变得越来越浅,说明有漂白性;如果SO2和Cl2的进气速度不相等,混合发生反应后其中一种气体有剩余,仍具有漂白性.
所以答案是:控制SO2和Cl2进气的物质的量,使之不相等.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】下列四个试管中,发生如下反应:Zn+2HCl=ZnCl2+H2↑,产生H2的反应速率最小的是( )
试管 | 盐酸浓度 | 温度 | 锌的状态 |
A | 0.5molL﹣1 | 20℃ | 块 状 |
B | 0.5molL﹣1 | 20℃ | 粉末状 |
C | 2molL﹣1 | 35℃ | 块 状 |
D | 2molL﹣1 | 35℃ | 粉末状 |
A.A
B.B
C.C
D.D
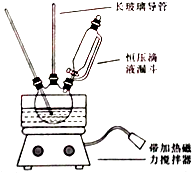
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下: ①配制混酸:组装如图反应装置.取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中.把18 mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50﹣60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.已知
(i) ![]() +HNO3(浓)
+HNO3(浓) ![]()
![]() +H2O
+H2O 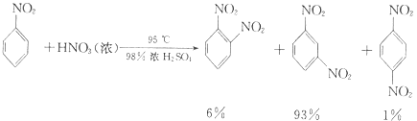
(ii)可能用到的有关数据列表如下
物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/gcm﹣3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
1,3﹣二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
请回答下列问题:
(1)配置混酸应先在烧杯中先加入 .
(2)恒压滴液漏斗的优点是 .
(3)实验装置中长玻璃管可用代替(填仪器名称).
(4)反应结束后产品在液体的层(填“上”或者“下”),分离混酸和产品的操作方法为
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? .
(6)为了得到更纯净的硝基苯,还须先向液体中加入除去水,然后蒸馏,最终得到17.5g硝基苯,则硝基苯的产率为(保留两位有效数字).若加热后,发现未加沸石,应采取的操作是 .