题目内容
将一定质量的Na2CO3和NaHCO3混合物灼烧至恒重,将放出的气体通入足量的Ca(OH)2饱和溶液中,充分反应后得到的沉淀的质量是1.0g,加热后剩余的固体物质与足量的稀盐酸反应,收集到2.2g气体,计算原固体混合物中Na2CO3与NaHCO3的质量.(答案保留到小数点后一位).
【答案】分析:根据发生的反应有2NaHCO3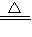 Na2CO3+H2O+CO2↑、Na2CO3+2HCl═2NaCl+H2O+CO2↑、CO2+Ca(OH)2═CaCO3↓+H2O,以此来计算解答.
Na2CO3+H2O+CO2↑、Na2CO3+2HCl═2NaCl+H2O+CO2↑、CO2+Ca(OH)2═CaCO3↓+H2O,以此来计算解答.
解答:解:设NaHCO3质量为x,Na2CO3质量为y,依题意得
2NaHCO3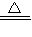 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
168 106 44
x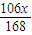
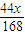
CO2+Ca(OH)2═CaCO3↓+H2O
44 100
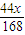 1.0g
1.0g
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
y+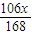 2.2 g
2.2 g
解得x=1.68g,y=4.24g,
答:原固体混合物中Na2CO3的质量为4.24g,NaHCO3的质量为1.68g.
点评:本题考查学生利用化学反应方程式的计算,明确发生的化学反应是解答本题的关键,难度不大.
 Na2CO3+H2O+CO2↑、Na2CO3+2HCl═2NaCl+H2O+CO2↑、CO2+Ca(OH)2═CaCO3↓+H2O,以此来计算解答.
Na2CO3+H2O+CO2↑、Na2CO3+2HCl═2NaCl+H2O+CO2↑、CO2+Ca(OH)2═CaCO3↓+H2O,以此来计算解答.解答:解:设NaHCO3质量为x,Na2CO3质量为y,依题意得
2NaHCO3
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑168 106 44
x
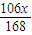
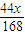
CO2+Ca(OH)2═CaCO3↓+H2O
44 100
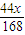 1.0g
1.0gNa2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
y+
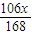 2.2 g
2.2 g解得x=1.68g,y=4.24g,
答:原固体混合物中Na2CO3的质量为4.24g,NaHCO3的质量为1.68g.
点评:本题考查学生利用化学反应方程式的计算,明确发生的化学反应是解答本题的关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目