题目内容
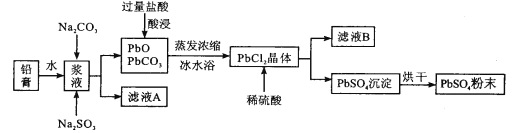
【题目】废旧铅蓄电池经粗加工可得到铅膏,其主要成分为PbO、PbO2、PbSO4等。以铅膏为原料回收PbSO4,流程如下:
已知:PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)ΔH>0
PbCl42-(aq)ΔH>0
(1)用Na2CO3作转化剂,将铅膏中的硫酸铅转化为碳酸铅,其离子方程式为_______。
(2)浆液中加入Na2SO3溶液的目的是________。
(3)从滤液A提取Na2SO4·10H2O晶体,主要步骤为______、______、过滤、洗涤、干燥;上述流程中可循环利用的物质是_________(写化学式)。
(4)采用冰水浴得PbCl2晶体的原因是________。
(5)理论上要得到a吨的PbSO4,则铅膏的质量范围为_________。
【答案】 PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq) 将PbO2还原为PbO 蒸发浓缩 冷却结晶 HCl 由于PbCl2(s)+2Cl-(aq)
PbCO3(s)+SO42-(aq) 将PbO2还原为PbO 蒸发浓缩 冷却结晶 HCl 由于PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)ΔH>0,温度降低,平衡向生成PbCl2的方向移动,获得PbCl2晶体 (0.74a吨,a吨)或0.74a吨<m<a吨或223a/303吨<m<a吨
PbCl42-(aq)ΔH>0,温度降低,平衡向生成PbCl2的方向移动,获得PbCl2晶体 (0.74a吨,a吨)或0.74a吨<m<a吨或223a/303吨<m<a吨
【解析】(1)用Na2CO3作转化剂,将铅膏中的硫酸铅转化为碳酸铅,根据原子守恒可知还有硫酸钠生成,其离子方程式为PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq);(2)亚硫酸钠具有还原性,可以把+4价Pb还原为+2价,因此浆液中加入Na2SO3溶液的目的是将PbO2还原为PbO;(3)滤液A能用来提取Na2SO4·10H2O,提取该晶体的主要步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥等;硫酸与PbCl2反应生成PbSO4和HCl,所以上述流程中可循环利用的物质是HCl;(4)由于PbCl2(s)+2Cl-(aq)
PbCO3(s)+SO42-(aq);(2)亚硫酸钠具有还原性,可以把+4价Pb还原为+2价,因此浆液中加入Na2SO3溶液的目的是将PbO2还原为PbO;(3)滤液A能用来提取Na2SO4·10H2O,提取该晶体的主要步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥等;硫酸与PbCl2反应生成PbSO4和HCl,所以上述流程中可循环利用的物质是HCl;(4)由于PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) ΔH>0,即反应为吸热反应,因此温度降低,平衡向生成PbCl2的方向移动,从而获得PbCl2晶体,所以采用冰水浴;(5)如果铅膏全部是硫酸铅,则需要铅膏a吨;PbO中Pb的含量最高,所以全部是PbO时需要铅膏的质量根据Pb原子守恒可知PbO~PbSO4,因此有
PbCl42-(aq) ΔH>0,即反应为吸热反应,因此温度降低,平衡向生成PbCl2的方向移动,从而获得PbCl2晶体,所以采用冰水浴;(5)如果铅膏全部是硫酸铅,则需要铅膏a吨;PbO中Pb的含量最高,所以全部是PbO时需要铅膏的质量根据Pb原子守恒可知PbO~PbSO4,因此有![]() ,即铅膏的质量m=
,即铅膏的质量m=![]() 吨,因此理论上要得到a吨的PbSO4,铅膏的质量范围为223a/303吨<m<a吨。
吨,因此理论上要得到a吨的PbSO4,铅膏的质量范围为223a/303吨<m<a吨。
