题目内容
【题目】某同学设计实验探究工业制乙烯的原理和乙烯的主要化学性质,实验装置如图所示(已知烃类都不与碱反应),请回答下列问题:
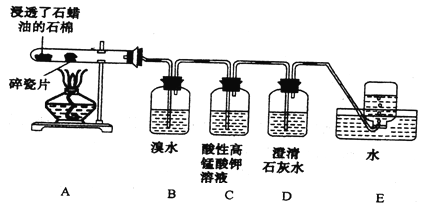
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。
例如,石油分馏产物之一的十六烧烃发生反应:C16H34![]() C8H18+甲,甲
C8H18+甲,甲![]() 4乙,则甲的分子式为______,乙的结构简式为________。
4乙,则甲的分子式为______,乙的结构简式为________。
(2)B装置中的实验现象可能是______,写出反应的化学方程式:______ , 其反应类型是_________。
(3)C装置中可观察到的现象是_______,反应类型是________。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置_______ (填字母)中的实验现象可判断该资料是否真实。为了探究溴与乙烯反应是加成反应而不是取代反应,可以测定装置B中溶液在反应前后的酸碱性,简述其理由:_________。
(5)通过上述实验探究,检验甲烷和乙烯的方法是______(选填字母,下同);除去甲烷中乙烯的方法是_______。
A.气体通入水中 B.气体通过盛溴水的洗气瓶
C.气体通过盛酸性高锰酸钾溶液的洗气瓶 D.气体通过氢氧化钠溶液
【答案】 C8H16 CH2=CH2 橙色(或橙黄色)褪去 CH2=CH2+Br2![]() BrCH2-CHBr 加成反应 紫色(或紫红色)褪去 氧化反应 D 若乙烯与溴发生取代反应生成HBr,其溶液酸性会显着增强 BC B。
BrCH2-CHBr 加成反应 紫色(或紫红色)褪去 氧化反应 D 若乙烯与溴发生取代反应生成HBr,其溶液酸性会显着增强 BC B。
【解析】考查实验方案设计与评价,(1)根据原子守恒,则甲的分子式为C8H16,乙的分子式为C2H4,即乙的结构简式为CH2=CH2;(2)乙烯是气体,因发生加成反应使溴水褪色,即装置B的实验现象是橙色或橙黄色褪色,反应方程式为CH2=CH2+Br2→ BrCH2-CHBr ;(3)乙烯能使酸性高锰酸钾溶液褪色,此反应是氧化反应;(4)CO2能使澄清石灰水变浑浊,因此当D装置中出现浑浊,说明产生CO2;如果乙烯和溴水发生取代反应,则生成HBr,HBr的水溶液显酸性,因此有:若乙烯与溴发生取代反应生成HBr,其溶液酸性会显着增强 ;(5)甲烷和乙烯都不溶于水和与氢氧化钠反应,甲烷的性质相对稳定,不能使溴水、高锰酸钾溶液褪色,但乙烯可以使溴水和高锰酸钾溶液褪色,因此检验甲烷和乙烯,BC正确;因为乙烯能被酸性高锰酸钾溶液氧化成二氧化碳,产生新的杂质,因此除去甲烷中的乙烯用溴水,即B正确。