题目内容
【题目】Ⅰ.完成下列反应的离子方程式
(1)实验室制备Fe(OH)3胶体的离子方程式:______________
(2)20mL0.1mol/L的Ca(HCO3)2溶液与30mL0.1mol/L的NaOH溶液混合反应的离子方程式:________________
Ⅱ.(3)用双线桥标出下列反应电子转移的方向和数目并回答:__________________11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4
(4)该反应氧化剂是________;氧化产物是________
(5)该反应每1molCuSO4能氧化________molP(填字母)
A.11/15 B.2/5 C.1/3 D.1/5
【答案】 Fe3++3H2O(沸水) ![]() Fe(OH)3(胶体)+3H+ 2Ca2++3HCO3-+3OH-=2CaCO3↓+CO32-+3H2O
Fe(OH)3(胶体)+3H+ 2Ca2++3HCO3-+3OH-=2CaCO3↓+CO32-+3H2O 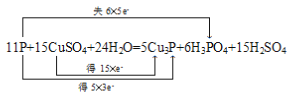 P CuSO4 H3PO4 D
P CuSO4 H3PO4 D
【解析】试题分析:本题考查Fe(OH)3胶体的制备,离子方程式的书写,氧化还原反应的分析和计算。
I.(1)实验室制备Fe(OH)3胶体的操作是:向煮沸的蒸馏水中加入5~6滴饱和FeCl3溶液,继续加热至溶液呈红褐色,停止加热制得Fe(OH)3胶体,反应的离子方程式为:Fe3++3H2O(沸水) ![]() Fe(OH)3(胶体)+3H+。
Fe(OH)3(胶体)+3H+。
(2)n[Ca(HCO3)2]=0.1mol/L![]() 0.02L=0.002mol,n(NaOH)=0.1mol/L
0.02L=0.002mol,n(NaOH)=0.1mol/L![]() 0.03L=0.003mol,0.003molOH-与0.003molHCO3-反应生成0.003molH2O和0.003molCO32-,0.002molCa2+沉淀消耗0.002molCO32-,最后还余下0.001molCO32-,即反应的Ca2+、HCO3-、OH-物质的量之比为2:3:3,反应的离子方程式为:2Ca2++3HCO3-+3OH-=2CaCO3↓+CO32-+3H2O。
0.03L=0.003mol,0.003molOH-与0.003molHCO3-反应生成0.003molH2O和0.003molCO32-,0.002molCa2+沉淀消耗0.002molCO32-,最后还余下0.001molCO32-,即反应的Ca2+、HCO3-、OH-物质的量之比为2:3:3,反应的离子方程式为:2Ca2++3HCO3-+3OH-=2CaCO3↓+CO32-+3H2O。
II.(3)用双线桥分析该反应为: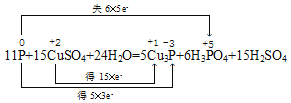 ,答案为:
,答案为: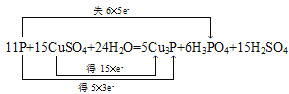 。
。
(4)根据上述分析,该反应中氧化剂为P和CuSO4,氧化产物为H3PO4。
(5)根据得失电子守恒,1mol![]() 1=n(P)
1=n(P)![]() 5,n(P)=1/5mol,每1molCuSO4能氧化1/5molP,答案选D。
5,n(P)=1/5mol,每1molCuSO4能氧化1/5molP,答案选D。