题目内容
18.电化学原理在能量转换、物质合成、防止金属腐蚀等方面应用广泛.Ⅰ.下列是常见的电化学示意图
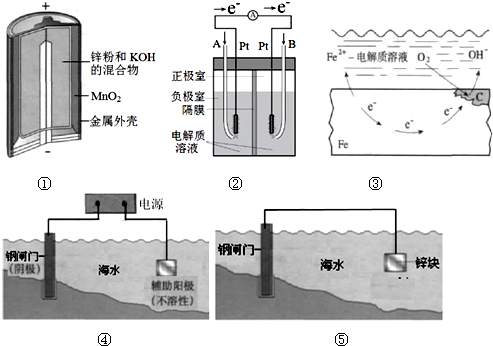
(1)图①是碱性锌猛电池,在正极发生反应的物质是MnO2(填“Zn”或“MnO2”),正极发生还原反应(填“氧化”或“还原”).
(2)图②是酸性电解质的氢氧燃料电池,B极发生的电极反应是O2+4H++4e-═2H2O.
(3)图③表示钢铁发生吸氧腐蚀生锈的示意图,写出氧气发生的电极反应2H2O+O2+4e-═4OH-.
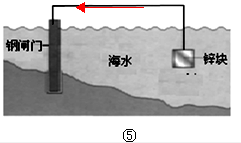
(4)能表示“牺牲阳极的阴极保护法”的示意图是⑤(填序号).图④中,钢闸门连接电源的负极而被保护;在图⑤中标出电子的移动方向
 .
.Ⅱ.下列是常见的电化学装置图.
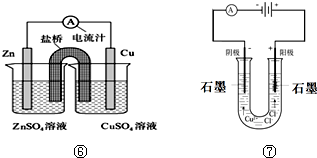
(5)图⑥中电池的总反应为Zn+Cu2+═Cu+Zn2+,盐桥中装有含琼脂的KCl,盐桥中Cl-会移向左(填“左”或“右”)烧杯的溶液.
(6)检验图⑦中阳极产物的方法是将湿润的淀粉KI试纸放在阳极产生气体处,试纸变蓝.
分析 (1)原电池中,正极失去电子发生氧化反应,负极得到电子发生还原反应,进行进行分析;
(2)燃料电池中,得到电子的一极为正极,失去电子的一极为负极,根据图示可知,B得到电子,电极反应为氧气得到电子与氢离子结合生成水;
(3)钢铁的吸氧腐蚀中,氧气得到电子生成氢氧根离子;
(4)金属防腐的措施中,使用牺牲阳极的阴极保护法,说明该装置构成原电池,被保护的金属作正极,据此分析解答;
(5)锌比铜活泼,锌为负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,铜为正极,发生还原反应,电极方程式为Cu2++2e-=Cu,原电池工作时,电子由负极经外电路流向正极,盐桥中阳离子向正极移动,阴离子向负极移动,据此进行解答;
(6)图⑦为惰性电极电解氯化铜溶液,阳极氯离子失去电子生成氯气,检验氯气通常使用湿润的淀粉KI试纸.
解答 解:Ⅰ.(1)碱性锌猛电池中,Zn为负极,MnO2为正极,正极得到电子发生还原反应,
故答案为:MnO2;还原;
(2)图②是酸性电解质的氢氧燃料电池,B极得到电子,则B为正极,正极氧气得到电子,其电极反应是:O2+4H++4e-═2H2O,
故答案为:O2+4H++4e-═2H2O;
(3)钢铁的吸氧腐蚀中,负极金属失去电子发生氧化反应,正极氧气得到电子生成氢氧根离子,正极的电极反应式为:2H2O+O2+4e-═4OH-,
故答案为:2H2O+O2+4e-═4OH-;
(4)图⑤中钢闸门连接锌,铁、锌、海水构成原电池,Fe失电子能力小于Zn而作正极被保护,所以该保护方法属于牺牲阳极的阴极保护法;
图④中右边为辅助阳极,则钢闸门为阴极,阴极连接的是电源的负极;图⑤中电子从锌流出流向正极钢闸门,据此画出电子转移的方向为: ,
,
故答案为:⑤;负; ;
;
Ⅱ.(5)该原电池中,负极上锌失电子生成锌离子,正极上铜离子得到生成铜,电池反应式为:Zn+Cu2+=Zn2++Cu;原电池工作时,电解质溶液中的阳离子向正极移动,阴离子向正极移动,则盐桥中Cl-会移向移向左边,
故答案为:Zn+Cu2+═Cu+Zn2+;左;
(6)图⑦中用石墨电极电解氯化铜溶液,阴极铜离子得到电子生成铜,阳极氯离子放电生成氯气,检验氯气的方法为:将湿润的淀粉KI试纸放在阳极产生气体处,试纸变蓝,
故答案为:将湿润的淀粉KI试纸放在阳极产生气体处,试纸变蓝.
点评 本题考查了原电池、电解池的工作原理,题目难度中等,明确原电池、电解池的工作原理及其应用方法为解答关键,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | Na2O2 | B. | CaCl2 | C. | Na2S | D. | H2SO4 |
| A. | 11.2 L氧气中所含有的原子数为NA | |
| B. | 标准状况下,22.4LCCl4所含分子数为NA | |
| C. | 7.8g的Na2O2中含有的阴离子的数目为0.2NA | |
| D. | 27g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是3NA |
| A. | 生成水蒸气体积为6.72m/NA L | B. | 参加反应的氨气为m/5 mol | ||
| C. | 生成NO的质量为6mNA g | D. | 发生还原反应的原子数为m/2 个 |
| A. | 遇碘单质是否变蓝-淀粉和纤维素 | |
| B. | 遇浓硝酸是否变黄-某些蛋白质和油脂 | |
| C. | 与氯气混合后光照,气体颜色是否逐渐变浅-甲烷和乙烷 | |
| D. | 与新制的氢氧化铜共热是否产生砖红色沉淀-葡萄糖和蔗糖 |
| 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)第三周期元素除⑩外原子半径最小的是Cl(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是NaOH(填化学式),具有两性的是Al(OH)3(填化学式).
(3)⑤⑥⑦三元素的金属性强弱顺序为Na>Mg>Al(填元素符号),判断的实验依据是单质与水或酸反应的剧烈程度(写出一种).
(4)元素⑨的原子结构示意图为
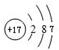 ;元素③的最低价氢化物的电子式为
;元素③的最低价氢化物的电子式为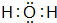 .
. | A. | CH2═CH2+HCl→CH3CH2Cl | B. |  +HO-NO2$→_{55~60℃}^{浓H_{2}SO_{4}}$ +HO-NO2$→_{55~60℃}^{浓H_{2}SO_{4}}$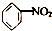 +H2O +H2O | ||
| C. | nCH2═CH2$\stackrel{一定条件}{→}$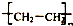 | D. | (C6H10O5)n+nH2O$\stackrel{一定条件}{→}$nC6H12O6 |
| A. | 溶液 | B. | 胶体 | C. | 悬浊液 | D. | 乳浊液 |
| A. | 铝粉和NaOH溶液制取氢气:2Al+2OH-═2AlO2-+H2↑ | |
| B. | Cu与浓硝酸反应:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O | |
| C. | 氢氧化钡溶液和稀硫酸反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向硫酸铝溶液中加入过量氨水:Al3++3 NH3.H2O═3NH4++Al(OH)3↓ |