题目内容
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素。下列说法正确的是
- A.1 mol 由元素A、B组成的化合物一定含有18 mol e-
- B.元素C、D的最高价氧化物对应的水化物之间不可能发生反应
- C.含D的盐溶液既可能显酸性,也可能显碱性
- D.化合物AE与CE含有相同类型的化学键
C
试题分析:B的原子最外层电子数是其电子层数的2倍,则B是C,A常温下是气体且原子序数比B小,则A是H,C在同周期的主族元素中原子半径最大,则C是Na,D是地壳中含量最多的金属元素,则D是Al,E单质是气体,则E是Cl。C和H形成的化合物有很多种,比如甲烷就不是18e-,A错误;Al(OH)3是两性氢氧化物,可以跟NaOH溶液反应,B错误;铝盐呈酸性,偏铝酸盐显碱性,C正确;HCl含有共价键,NaCl含有离子键,D错误。答案选C。
考点:元素周期律
点评:元素的性质随着原子序数的递增而呈现出周期性的变化,称为元素周期律。元素的性质主要是指原子半径、主要化合价和金属性以及非金属性等。该题主要考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
试题分析:B的原子最外层电子数是其电子层数的2倍,则B是C,A常温下是气体且原子序数比B小,则A是H,C在同周期的主族元素中原子半径最大,则C是Na,D是地壳中含量最多的金属元素,则D是Al,E单质是气体,则E是Cl。C和H形成的化合物有很多种,比如甲烷就不是18e-,A错误;Al(OH)3是两性氢氧化物,可以跟NaOH溶液反应,B错误;铝盐呈酸性,偏铝酸盐显碱性,C正确;HCl含有共价键,NaCl含有离子键,D错误。答案选C。
考点:元素周期律
点评:元素的性质随着原子序数的递增而呈现出周期性的变化,称为元素周期律。元素的性质主要是指原子半径、主要化合价和金属性以及非金属性等。该题主要考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
相关题目
已知A、B、C、D分别是Cu、Ag、Fe、Al四种金属中的一种.已知①A、C均能与稀硫酸反应放出气体;②B与D的硝酸盐反应,置换出单质D;③C与强碱反应放出气体,由此可以推断A、B、C、D依次是( )
| A、Fe、Cu、Al、Ag | B、Al、Cu、Fe、Ag | C、Cu、Ag、Al、Fe | D、Ag、Al、Cu、Fe |

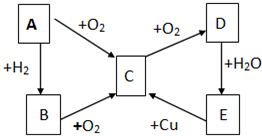 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素. (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答: