题目内容
【题目】合成氨工业对国民经济和社会发展具有重要意义。对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
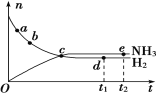
A. 点a的正反应速率比点b的小B. 点c处反应达到平衡
C. 点d(t1时刻)和点e(t2时刻)处n(N2)不一样D. 点e处反应达到平衡
【答案】D
【解析】
在N2(g)+3H2(g)2NH3(g)反应中,随着反应的进行,反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,当达到平衡状态时,正逆反应速率相等,反应物和生成物的物质的量均不再改变,曲线为水平直线,据此分析解答。
A.从a点到b点,氢气的物质的量在逐渐减少,氢气的物质的量浓度在逐渐减少,所以正反应的反应速率在逐渐降低,即点a的正反应速率比点b的大,故A错误;
B.由图可知,c点反应物和生成物的物质的量仍在变化,反应没有达到平衡状态,故B错误;
C.d点和e点都处于平衡状态,n(N2)不变,即d点和e点n(N2)相等,故C错误;
D.由图像可知e点氨气的物质的量不变,说明达到平衡状态,故D正确;
答案选D。

练习册系列答案
相关题目



