题目内容
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水![]() 混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为
混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为![]() 。下列有关说法正确的是
。下列有关说法正确的是

A. 正极反应式:![]()
B. 放电过程中,![]() 向负极移动
向负极移动
C. 常温时,在正负极间接上电流表或检流计,指针发生偏转
D. 每转移0.1mol电子,理论上生成10.35gPb
【答案】D
【解析】
由原电池总反应可以知道Ca为原电池的负极,发生氧化反应,电极方程式为Ca+2Cl--2e-=CaCl2,硫酸铅为原电池的正极,发生还原反应,电极方程式为PbSO4+2e-+2Li+=Li2SO4+Pb,原电池工作时,阳离子向正极移动,阴离子向负极移动,结合电解方程式计算。
A.正极发生还原反应,电极方程式为PbSO4+2e-+2Li+=Li2SO4+Pb,故A错误;
B.放电过程中阳离子向正极移动,Li+向正极移动,故B错误;
C.常温下,电解质不是熔融态,离子不能移动,不能产生电流,因此连接电流表或检流计,指针不偏转,故C错误;
D.根据电极方程式PbSO4+2e-+2Li+=Li2SO4+Pb,可以知道每转移0.1mol电子,理论上生成0.05molPb,质量为10.35g,所以D选项是正确的。
所以D选项是正确的。

 阅读快车系列答案
阅读快车系列答案【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下图装置用正丁醇合成正丁醛。相关数据如下:
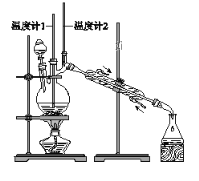
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物