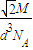题目内容
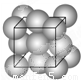
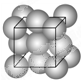 金晶体的晶胞如图所示立方面心堆积.设金原子的直径为d,用NA表示阿伏加德罗常数,在立方体的各个面的对角线上3个金原子彼此两两相切,M表示金的摩尔质量.则下列说法错误的是( )
金晶体的晶胞如图所示立方面心堆积.设金原子的直径为d,用NA表示阿伏加德罗常数,在立方体的各个面的对角线上3个金原子彼此两两相切,M表示金的摩尔质量.则下列说法错误的是( )分析:A、Au原子处于顶点与面心上,根据均摊法计算晶胞中含有的Au原子数目;
B、金属晶体中,金属原子采取紧密堆积;
C、在立方体的各个面的对角线上3个金原子彼此两两相切,金原子的直径为d,故面对角线长度为2d,棱长为
×2d=
d,据此计算;
D、根据晶胞中原子数目计算结合摩尔质量,计算晶胞质量,再根据密度定义计算金晶体的密度.
B、金属晶体中,金属原子采取紧密堆积;
C、在立方体的各个面的对角线上3个金原子彼此两两相切,金原子的直径为d,故面对角线长度为2d,棱长为
| ||
| 2 |
| 2 |
D、根据晶胞中原子数目计算结合摩尔质量,计算晶胞质量,再根据密度定义计算金晶体的密度.
解答:解:A、Au原子处于顶点与面心上,算晶胞中含有的Au原子数目为8×
+6×
=4,故A正确;
B、金属晶体中,金属键无方向性,金属原子采取紧密堆积,故B正确;
C、在立方体的各个面的对角线上3个金原子彼此两两相切,金原子的直径为d,故面对角线长度为2d,棱长为
×2d=
d,故晶胞的体积为(
d)3=2
d3,故C错误;
D、晶胞中含有4个原子,故晶胞质量为
,晶胞的体积为2
d3,故晶胞密度
=
,故D正确;
故选C.
| 1 |
| 8 |
| 1 |
| 2 |
B、金属晶体中,金属键无方向性,金属原子采取紧密堆积,故B正确;
C、在立方体的各个面的对角线上3个金原子彼此两两相切,金原子的直径为d,故面对角线长度为2d,棱长为
| ||
| 2 |
| 2 |
| 2 |
| 2 |
D、晶胞中含有4个原子,故晶胞质量为
| 4M |
| NA |
| 2 |
| ||
2
|
| ||
| d3NA |
故选C.
点评:本题考查晶胞的有关计算等,难度中等,注意根据均摊法计算晶胞中原子数目,计算晶胞的棱长是计算的关键.

练习册系列答案
相关题目








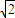 d 3
d 3