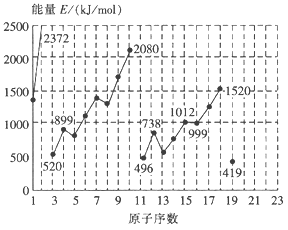
题目内容
【题目】常温下,下列各组微粒在指定溶液中可能大量共存的是( )
A.![]() =1×1014的溶液:NH4+、CrO42-、HS-
=1×1014的溶液:NH4+、CrO42-、HS-
B.含大量NO3-的溶液:Fe2+、SO42-、H+
C.水电离产生的c(OH-)=10-13 mol/L的溶液:Mg2+、Na+、Cl-
D.甲基橙呈红色的溶液:NH4+、Ba2+、HCO3-、Cl-
【答案】C
【解析】
A.![]() =1×1014的溶液显酸性,CrO42-、HS-之间发生氧化还原反应,不能大量共存,故A错误;
=1×1014的溶液显酸性,CrO42-、HS-之间发生氧化还原反应,不能大量共存,故A错误;
B.NO3-、Fe2+、H+之间发生氧化还原反应,不能大量共存,故B错误;
C.水电离产生的c(OH-)=10-13mol/L的溶液呈酸性或碱性,Mg2+、Na+、Cl-之间不反应,都不与氢离子反应,在酸性溶液中可以大量共存,故C正确;
D.甲基橙呈红色的溶液显酸性,溶液中存在大量氢离子,HCO3-与氢离子能够反应,不能大量共存,故D错误;
故选C。

【题目】氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.2000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1) 配平离子方程式:______MnO4-+HSO3-+H+=Mn2++SO42-+H2O。
(2)用KMnO4进行滴定时,KMnO4溶液应装在_______________中,判断滴定终点的现象是_______。
(3)下列操作会导致测定结果偏高的是_________。
A. 盛装未知浓液的锥形瓶用蒸馏水洗过,未用待测液润洗
B. 未用标准浓度的酸性KMnO4溶液润洗滴定管
C. 观察读数时,滴定前仰视,滴定后俯视
D. 滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
(4) 根据下表测定的实验数据,计算KMnO4溶液体积的平均值为___mL;NaHSO3溶液的物质的量浓度为___mol/L(数据精确到0.1)。
试验编号 | 待测NaHSO3溶液的体积/ mL | KMnO4溶液体积/ mL |
1 | 20.00 | 15.98 |
2 | 20.00 | 17.00 |
3 | 20.00 | 16.02 |