题目内容
将过量的铁粉投入一定量的热浓硫酸中(含2 mol H2SO4),按照中学教材上H2SO4与铁反应的有关知识填空:
(1)若反应结束后,有1.5 mol铁被溶解,产生的气体是_______,质量为_______g。
(2)反应停止后,有W g铁粉溶解,产生的SO2在标准状况下所占有的体积是_______L。
(1)若反应结束后,有1.5 mol铁被溶解,产生的气体是_______,质量为_______g。
(2)反应停止后,有W g铁粉溶解,产生的SO2在标准状况下所占有的体积是_______L。
(1)SO2、H2 34
(2)
(2)

(1)根据浓、稀硫酸的性质不同,当向浓H2SO4中投入过量铁粉时,先生成SO2,后生成H2。由Fe+2H2SO4====FeSO4+SO2↑+2H2O和Fe+H2SO4====FeSO4+H2↑,设生成H2的物质的量为x,SO2为y。
则x+y="1.5 " ①
x+2y="2 " ②
解之:x="1" mol,y="0.5" mol。
(2)设此时生成SO2的物质的量为m,H2的物质的量为n,则m+n="W/56 " ①
2m+n="2 " ②
解之: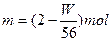 ,其体积为
,其体积为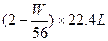 。
。
则x+y="1.5 " ①
x+2y="2 " ②
解之:x="1" mol,y="0.5" mol。
(2)设此时生成SO2的物质的量为m,H2的物质的量为n,则m+n="W/56 " ①
2m+n="2 " ②
解之:
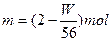 ,其体积为
,其体积为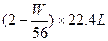 。
。
练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
 溶液+气体;
溶液+气体;