题目内容
13.9.8gH2SO4的物质的量是0.1mol;2.0molH2O的质量是36g.分析 根据n=$\frac{m}{M}$计算硫酸的物质的量,根据m=nM计算水的质量.
解答 解:H2SO4的摩尔质量为98g/mol,9.8gH2SO4的物质的量是$\frac{9.8g}{98g/mol}$=0.1mol;
H2O的摩尔质量为18g/mol,2.0molH2O的质量是2mol×18g/mol=36g,
故答案为:0.1mol;36g.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的计算.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
3.在过滤的操作中,必须使用的仪器是( )
| A. |  锥形瓶 | B. |  漏斗 | C. | 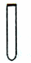 试管 | D. |  容量瓶 |
4.进入秋冬季节后,雾霾这种环境污染问题逐渐凸显.从物质分类来看雾霾属于胶体,它区别于溶液等其它分散系的本质特征是( )
| A. | 产生丁达尔现象 | B. | 胶体是混合物 | ||
| C. | 分散质粒子直径在1nm~100nm之间 | D. | 胶体的分散剂为气体 |
18.下列说法正确的是( )
| A. | 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1,则H2的燃烧热为-285.8 kJ•mol-1 | |
| B. | 已知:S(g)+O2(g)═SO2(g)△H1=-Q1;S(s)+O2(g)═SO2(g)△H2=-Q2,则Q1<Q2 | |
| C. | 已知:$\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H1;CH3COOH(aq)+NH3•H2O(aq)═CH3COONH4(aq)+H2O(l)△H2,则有|△H1|<|△H2| | |
| D. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H=+489.0 kJ•mol-1 CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ•mol-1 C(石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 则4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1 641.0 kJ•mol-1 |
5.下列说法正确的是( )
| A. | 明矾用于净水与K+、Al3+的水解有关 | |
| B. | 配制FeCl3溶液时,为了抑制Fe3+的水解,常加入少量稀硫酸 | |
| C. | 常常用排饱和食盐水的方法收集氯气,可以避免氯气溶于水而损失 | |
| D. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 |
2.实验室需配制95mL 1mol/L的Na2CO3溶液,应选用的容量瓶的规格和称取Na2CO3的质量分别是( )
| A. | 100mL,10.6g | B. | 100mL,10.1g | C. | 500mL,10.1g | D. | 500mL,10.6g |
3.在VL密闭容器中,通入0.2mol SO2和0.2mol SO3气体,在一定条件下发生反应:2SO2+O2?2SO3.平衡时SO3为amol;在相同温度下按下列配比在VL密闭容器中放入起始物质,平衡时有关SO3的正确叙述是( )
| A. | 放入0.2mol SO2、0.1molO2、0.1mol SO3,达到平衡时SO3必小于amol | |
| B. | 放入0.2mol SO2、0.1molO2、0.2mol SO3,达到平衡时SO3必大于amol | |
| C. | 放入0.4mol SO2、0.1molO2,达到平衡时SO3会等于0.4amol | |
| D. | 放入0.2mol SO2、0.1molO2,达到平衡时SO3必小于amol |
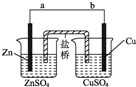 某学生利用如图实验装置探究盐桥式原电池的工作原理
某学生利用如图实验装置探究盐桥式原电池的工作原理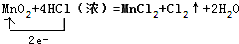 .
.