题目内容
[选修一化学与技术]联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图:
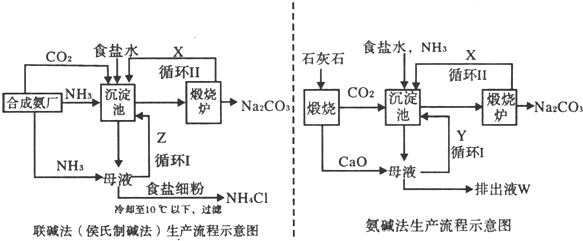
(1)沉淀池中发生反应的化学方程式为______;
(2)X是______,Y是______ (填化学式);
(3)Z中除了溶解的氨气、食盐外,其它溶质还有______;排出液中的溶质除了氢氧化钙外,还有______;
(4)从理论上分析,在氨碱法生产过程中______ (填“需要”、“不需要”)补充氨气,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为______;
(5)根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是______;
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
(6)联碱法中,每当通入NH3 44.8L(巳折合成标准状况下)时可以得到纯碱100.0g则NH3的利用率为______.相比于氨碱法,指出联碱法的一项优点______?

(1)沉淀池中发生反应的化学方程式为______;
(2)X是______,Y是______ (填化学式);
(3)Z中除了溶解的氨气、食盐外,其它溶质还有______;排出液中的溶质除了氢氧化钙外,还有______;
(4)从理论上分析,在氨碱法生产过程中______ (填“需要”、“不需要”)补充氨气,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为______;
(5)根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是______;
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
(6)联碱法中,每当通入NH3 44.8L(巳折合成标准状况下)时可以得到纯碱100.0g则NH3的利用率为______.相比于氨碱法,指出联碱法的一项优点______?
(1)依据流程图分析可知,生产流程联碱法和氨碱法生产流程中沉淀池中发生的反应是氨气、二氧化碳、水、氯化钠反应生成碳酸氢钠晶体和氯化铵,所以反应的化学方程式为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl,故答案为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;
(2)联碱法生产流程图中分析循环Ⅱ中是碳酸氢钠分解生成的二氧化碳气体;氨碱法的生产流程中循环Ⅰ是氧化钙和水反应生成氢氧化钙,氢氧化钙与铵盐反应生成的氨气可以循环使用,故答案为:CO2;NH3;
(3)依据两个过程中的物质发生的反应分析,联碱法母液主要是氯化铵、碳酸钠、碳酸氢钠、氯化钠;Z中除了溶解的氨气、食盐外,其它溶质还有氯化铵、碳酸钠;氨碱法排出液中的溶质除了氢氧化钙外,还有氢氧化钙和氯化铵反应生成的氯化钙,氯化钠,故答案为:Na2CO3、NH4Cl;CaCl2、NaCl;
(4)从理论上分析,氨碱法生产过程中,母液中加入氧化钙反应生成氢氧化钙会和铵盐生成氨气,反应过程中氨气转化为铵盐,铵盐转化为氨气,氨气循环使用,不需要补充氨气;
NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;CaCO3═CaO+CO2↑;CaO+H2O═Ca(OH)2;Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O;2NaHCO3═Na2CO3+H2O+CO2↑合并得到总化学方程式为:CaCO3+2NaCl═Na2CO3+CaCl2,故答案为:不需要;CaCO3+2NaCl═Na2CO3+CaCl2;
(5)联碱法中从母液中提取氯化铵晶体的过程中;
a、温时氯化铵的溶解度比氯化钠大,故a错误;
b、通氨气作用有增大NH4+的浓度,使NH4Cl更多地析出和使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度,故b正确;
c、加入食盐细粉目的是提高Cl-的浓度,促进氯化铵结晶析出,故c错误;
故答案为:b;
(6)联碱法中发生的反应为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;2NaHCO3═Na2CO3+H2O+CO2↑;每当通入NH3 44.8L(巳折合成标准状况下)物质的量为2mol;生产过程中得到纯碱100.0g,物质的量为
=
mol;需要氨气的物质的量为
×2=
mol;则NH3的利用率=
×100%=94.3%;
联合制碱法与氨碱法比较,其最大的优点是使食盐的利用率提高到96%以上,应用同量的食盐比氨碱法生产更多的纯碱.另外它综合利用了氨厂的二氧化碳和碱厂的氯离子,同时,生产出两种可贵的产品--纯碱和氯化铵.将氨厂的废气二氧化碳,转变为碱厂的主要原料来制取纯碱,这样就节省了碱厂里用于制取二氧化碳的庞大的石灰窑;将碱厂的无用的成分氯离子(Cl-)来代替价格较高的硫酸固定氨厂里的氨,制取氮肥氯化铵.从而不再生成没有多大用处,又难于处理的氯化钙,减少了对环境的污染,并且大大降低了纯碱和氮肥的成本,充分体现了大规模联合生产的优越性,
故答案为:94.3%;不产生无用的CaCl2,提高了食盐的转化率.
(2)联碱法生产流程图中分析循环Ⅱ中是碳酸氢钠分解生成的二氧化碳气体;氨碱法的生产流程中循环Ⅰ是氧化钙和水反应生成氢氧化钙,氢氧化钙与铵盐反应生成的氨气可以循环使用,故答案为:CO2;NH3;
(3)依据两个过程中的物质发生的反应分析,联碱法母液主要是氯化铵、碳酸钠、碳酸氢钠、氯化钠;Z中除了溶解的氨气、食盐外,其它溶质还有氯化铵、碳酸钠;氨碱法排出液中的溶质除了氢氧化钙外,还有氢氧化钙和氯化铵反应生成的氯化钙,氯化钠,故答案为:Na2CO3、NH4Cl;CaCl2、NaCl;
(4)从理论上分析,氨碱法生产过程中,母液中加入氧化钙反应生成氢氧化钙会和铵盐生成氨气,反应过程中氨气转化为铵盐,铵盐转化为氨气,氨气循环使用,不需要补充氨气;
NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;CaCO3═CaO+CO2↑;CaO+H2O═Ca(OH)2;Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O;2NaHCO3═Na2CO3+H2O+CO2↑合并得到总化学方程式为:CaCO3+2NaCl═Na2CO3+CaCl2,故答案为:不需要;CaCO3+2NaCl═Na2CO3+CaCl2;
(5)联碱法中从母液中提取氯化铵晶体的过程中;
a、温时氯化铵的溶解度比氯化钠大,故a错误;
b、通氨气作用有增大NH4+的浓度,使NH4Cl更多地析出和使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度,故b正确;
c、加入食盐细粉目的是提高Cl-的浓度,促进氯化铵结晶析出,故c错误;
故答案为:b;
(6)联碱法中发生的反应为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;2NaHCO3═Na2CO3+H2O+CO2↑;每当通入NH3 44.8L(巳折合成标准状况下)物质的量为2mol;生产过程中得到纯碱100.0g,物质的量为
| 100g |
| 106g/mol |
| 50 |
| 53 |
| 50 |
| 53 |
| 100 |
| 53 |
| ||
| 2mol |
联合制碱法与氨碱法比较,其最大的优点是使食盐的利用率提高到96%以上,应用同量的食盐比氨碱法生产更多的纯碱.另外它综合利用了氨厂的二氧化碳和碱厂的氯离子,同时,生产出两种可贵的产品--纯碱和氯化铵.将氨厂的废气二氧化碳,转变为碱厂的主要原料来制取纯碱,这样就节省了碱厂里用于制取二氧化碳的庞大的石灰窑;将碱厂的无用的成分氯离子(Cl-)来代替价格较高的硫酸固定氨厂里的氨,制取氮肥氯化铵.从而不再生成没有多大用处,又难于处理的氯化钙,减少了对环境的污染,并且大大降低了纯碱和氮肥的成本,充分体现了大规模联合生产的优越性,
故答案为:94.3%;不产生无用的CaCl2,提高了食盐的转化率.

练习册系列答案
相关题目