题目内容
氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用可产生NH3,请回答:(1)Na3N的电子式
(2)Na3N与水反应方程式为
(3)Na3N放入足量盐酸中生成
(4)比较Na3N中两种粒子的半径:r(Na+)
分析:(1)氮化钠为离子化合物,根据离子化合物的电子式书写方法写出其电子式;
(2)根据原子守恒,判断出氮化钠与与水反应产物,写出反应的化学方程式;
(3)根据氮化钠与水的反应,判断氮化钠与盐酸反应产物;
(4)具有相同电子排布的离子,原子序数大的离子半径小.
(2)根据原子守恒,判断出氮化钠与与水反应产物,写出反应的化学方程式;
(3)根据氮化钠与水的反应,判断氮化钠与盐酸反应产物;
(4)具有相同电子排布的离子,原子序数大的离子半径小.
解答:解:(1)钠元素和氮元素分别是活泼的金属和活泼的非金属,所以二者形成的化学键是离子键,Na3N的电子式为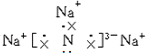 ,
,
故答案为: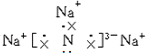 ;离子;
;离子;
(2)Na3N电离出Na+、N3-,H2O电离出H+、OH-,N3-和H+结合成为NH3,Na+与OH-结合成为NaOH,氮化钠和水发生了复分解反应,反应的方程式是Na3N+3H2O=3NaOH+NH3↑,
故答案为:Na3N+3H2O=3NaOH+NH3↑;复分解;
(3)氮化钠和水反应生成氨气,则根据原子守恒可判断,另外一种生成物应该是氢氧化钠,所以氮化钠和盐酸反应的生成物应该是NaCl和NH4Cl,共计是2种盐,
故答案为:2;NH4Cl、NaCl;
(4)Na+、N3-具有相同的电子排布,Na的原子序数大,则r(Na+)<r(N3-),故答案为:<.
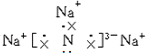 ,
,故答案为:
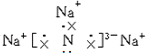 ;离子;
;离子;(2)Na3N电离出Na+、N3-,H2O电离出H+、OH-,N3-和H+结合成为NH3,Na+与OH-结合成为NaOH,氮化钠和水发生了复分解反应,反应的方程式是Na3N+3H2O=3NaOH+NH3↑,
故答案为:Na3N+3H2O=3NaOH+NH3↑;复分解;
(3)氮化钠和水反应生成氨气,则根据原子守恒可判断,另外一种生成物应该是氢氧化钠,所以氮化钠和盐酸反应的生成物应该是NaCl和NH4Cl,共计是2种盐,
故答案为:2;NH4Cl、NaCl;
(4)Na+、N3-具有相同的电子排布,Na的原子序数大,则r(Na+)<r(N3-),故答案为:<.
点评:本题考查化学键、化学方程式的书写及离子半径比较,题目难度不大,为基础性试题的考查,试题基础性强,注重能力训练,该题有利于巩固学生对教材基础知识的理解,培养学生的规范答题能力,提高学习效率.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目


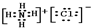

 、
、