��Ŀ����
��13�֣��ҹ��������Ϸ��ֺ�ʹ��ͭ��ͭ������Ĺ���֮һ��ֱ������ͭ���仯�����ڹ�ũҵ��������Ȼ���Ź㷺��Ӧ�á�
��1����ҵ�Ͽ����û�ͭ����Ҫ�ɷ�CuFeS2��Ϊԭ��ұ��ͭ����Ҫ��Ӧ����:
�� 2CuFeS2+4O2=Cu2S+3SO2+2FeO �� 2Cu2S + 3O2=2SO2+2Cu2O�� Cu2S+ 2Cu2O="6Cu+" SO2
�ڢ��б������뱻��ԭԪ��ԭ�ӵ����ʵ���֮��Ϊ ������3mol CuFeS2����3molCu������������O2�����ʵ���Ϊ ��
��2��������Cu2O������ϡ���ᣬ�õ���ɫ��Һ�ͺ�ɫ���壬�������ø����ʼ��鹤ҵ��ұ��ͭ�õ��Ĵ�ͭ���Ƿ���Cu2O��д���˷�Ӧ�����ӷ���ʽ ��
��3����ʴӡˢ��·�ķ�Һ�к��д�����CuCl2��FeCl2��FeCl3�������ŷŽ����»�����Ⱦ����Դ���˷ѣ� Ϊ��ʹFeCl3ѭ�����úͻ���CuCl2������������������̣�

���Լ�Y������ ������X����� ���ѧʽ����
����������1L��Һ�к�CuCl2��FeCl2��FeCl3�����ʵ���Ũ�Ⱦ�Ϊ0.5mol��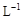 �� �����Cl2��������Xʹ��Һ��pH�� ��Χʱ������Һ������ֲ��䣩����Ԫ����ȫת��ΪFe(OH)3����CuCl2������������( KSP [Fe(OH)3]=1.0��10��38�� KSP[Cu(OH)2]=2.0��10��20 �� lg5=0.7)
�� �����Cl2��������Xʹ��Һ��pH�� ��Χʱ������Һ������ֲ��䣩����Ԫ����ȫת��ΪFe(OH)3����CuCl2������������( KSP [Fe(OH)3]=1.0��10��38�� KSP[Cu(OH)2]=2.0��10��20 �� lg5=0.7)
��1����ҵ�Ͽ����û�ͭ����Ҫ�ɷ�CuFeS2��Ϊԭ��ұ��ͭ����Ҫ��Ӧ����:
�� 2CuFeS2+4O2=Cu2S+3SO2+2FeO �� 2Cu2S + 3O2=2SO2+2Cu2O�� Cu2S+ 2Cu2O="6Cu+" SO2
�ڢ��б������뱻��ԭԪ��ԭ�ӵ����ʵ���֮��Ϊ ������3mol CuFeS2����3molCu������������O2�����ʵ���Ϊ ��
��2��������Cu2O������ϡ���ᣬ�õ���ɫ��Һ�ͺ�ɫ���壬�������ø����ʼ��鹤ҵ��ұ��ͭ�õ��Ĵ�ͭ���Ƿ���Cu2O��д���˷�Ӧ�����ӷ���ʽ ��
��3����ʴӡˢ��·�ķ�Һ�к��д�����CuCl2��FeCl2��FeCl3�������ŷŽ����»�����Ⱦ����Դ���˷ѣ� Ϊ��ʹFeCl3ѭ�����úͻ���CuCl2������������������̣�

���Լ�Y������ ������X����� ���ѧʽ����
����������1L��Һ�к�CuCl2��FeCl2��FeCl3�����ʵ���Ũ�Ⱦ�Ϊ0.5mol��
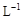 �� �����Cl2��������Xʹ��Һ��pH�� ��Χʱ������Һ������ֲ��䣩����Ԫ����ȫת��ΪFe(OH)3����CuCl2������������( KSP [Fe(OH)3]=1.0��10��38�� KSP[Cu(OH)2]=2.0��10��20 �� lg5=0.7)
�� �����Cl2��������Xʹ��Һ��pH�� ��Χʱ������Һ������ֲ��䣩����Ԫ����ȫת��ΪFe(OH)3����CuCl2������������( KSP [Fe(OH)3]=1.0��10��38�� KSP[Cu(OH)2]=2.0��10��20 �� lg5=0.7)��13�֣�
��1��1�s6 ��2�֣��� 7.5mol��3�֣�û��λ��1�֣���
��2��Cu2O��2H+��Cu��Cu2+��H2O ��2�֣�û��ƽ��1�֣���ѧʽ��0�֣�
��3����������Ȼ��⣨1�֣���CuO ��2�֣����� 3.0��4.3��3�֣�
��1��1�s6 ��2�֣��� 7.5mol��3�֣�û��λ��1�֣���
��2��Cu2O��2H+��Cu��Cu2+��H2O ��2�֣�û��ƽ��1�֣���ѧʽ��0�֣�
��3����������Ȼ��⣨1�֣���CuO ��2�֣����� 3.0��4.3��3�֣�
�����������1�� Cu2S+ 2Cu2O="6Cu+" SO2�У���������Ԫ�ؼ����ϼ����ߵ�Ԫ����SԪ�أ�����ԭ��Ԫ�ؼ����ϼ۽��͵�Ԫ����CuԪ�أ��ɷ���ʽ��֪�����б������뱻��ԭԪ��ԭ�ӵ����ʵ���֮��Ϊ1:6��
�ɢٵ�6CuFeS2��12O2��3Cu2S�� �ɢڵ� 2Cu2S �� 3O2��2Cu2O�� �ɢ�Cu2S�� 2Cu2O��6Cu���������յù�ϵʽ6CuFeS2��15O2��6Cu������3mol CuFeS2����3molCu������������O2�����ʵ���Ϊ7.5mol��
��2��������Cu2O������ϡ���ᣬ�õ���ɫ��Һ�ͺ�ɫ���壬����������ԭ��Ӧ���ۣ���ɫ��ҺΪ����ͭ��Һ����ɫ����Ϊ����ͭ�����ӷ���ʽΪCu2O��2H+��Cu��Cu2+��H2O��
��3�������������������Ȼ�������Ҫ�Լ�Y��ϡ������Ȼ��⣻����X��Ŀ���ǵ�����ҺpH��ʹ�����ӳ���������Ϊ�˲������µ����ʣ�X���ѡ��CuO��
�ڼ���������ͭ���ӵ�Ũ������0.5mol/L,�����ӵ�Ũ��Ϊ1.0mol/L�����������������ܶȻ���������������ȫ����ʱ��c��OH-��3=1.0��10��38 /1.0��10��5mol��
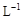 �� ��c��OH-��=1.0��10��11mol��
�� ��c��OH-��=1.0��10��11mol��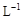 �� pH=3����ͭ���ӿ�ʼ����ʱ��c��OH-��2=2.0��10��20 /0.5=4.0��10��20mol��
�� pH=3����ͭ���ӿ�ʼ����ʱ��c��OH-��2=2.0��10��20 /0.5=4.0��10��20mol��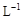 ��c��OH-��=2.0��10��10mol��
��c��OH-��=2.0��10��10mol��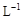 ��pH=4.3��������Ԫ����ȫת��ΪFe(OH)3����CuCl2����������ʱ��Һ��pH�ķ�Χ��3.0��4.3��
��pH=4.3��������Ԫ����ȫת��ΪFe(OH)3����CuCl2����������ʱ��Һ��pH�ķ�Χ��3.0��4.3��
��ϰ��ϵ�д�
 ������״Ԫ���Ծ�ϵ�д�
������״Ԫ���Ծ�ϵ�д�
�����Ŀ
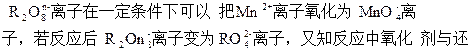
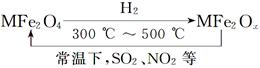
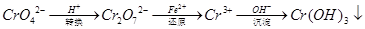
 Cr2O72��(aq)+H2O��1����ת����������Һ�и�Ԫ�غ���Ϊ28.6g/L��CrO42����10/11ת��ΪCr2O72��������˵������ȷ����
Cr2O72��(aq)+H2O��1����ת����������Һ�и�Ԫ�غ���Ϊ28.6g/L��CrO42����10/11ת��ΪCr2O72��������˵������ȷ����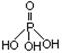 �������������ƣ��׳ơ����ơ����dz��õ�ˮ���������������ƣ�NaH2PO2�������ڻ�ѧ�����ȵȡ�
�������������ƣ��׳ơ����ơ����dz��õ�ˮ���������������ƣ�NaH2PO2�������ڻ�ѧ�����ȵȡ�