题目内容
(1)已知某混和气体的体积百分组成为80.0%CH4、15.0%C2H4和5.00%C2H6。请计算0.500 mol该混和气体的质量和标准状况下的密度(g/L)。
(2)CH4在一定条件下催化氧化可以生成C2H4、C2H6(水和其他反应产物忽略不计)。取一定量CH4经催化氧化后得到一种混和气体,它在标准状况下的密度为0.780g/L。已知反应中CH4消耗了20.0%,计算混和气体中C2H4的体积分数。(本题计算过程中请保留3位有效数字)
答案:
解析:
解析:
(1)0.500´(16´0.800+28´0.150+30´0.0500)=9.25(g);混合气体的密度为 9.25g/11.2L=0.826g/L。 (2)设反应前CH4为1mol,其中有xmol转化成C2H4,即生成x/2mol C2H4和(0.200-x)/2mol C2H6。反应后混合气体的总的物质的量为0.900mol。
|

练习册系列答案
相关题目
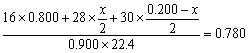 ,解得x=0.800,C2H4的体积分数为
,解得x=0.800,C2H4的体积分数为
 ②氨气可使湿润的红色的石蕊试纸变蓝的原因(用方程式表示)
②氨气可使湿润的红色的石蕊试纸变蓝的原因(用方程式表示)