题目内容
已知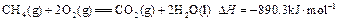 。现有0.75mol CH4和CO的混合气体,完全燃烧后生成CO2(g)和18g H2O(l),共放出515.9kJ热量,由上可知1mol CO完全燃烧放出的热量为( )
。现有0.75mol CH4和CO的混合气体,完全燃烧后生成CO2(g)和18g H2O(l),共放出515.9kJ热量,由上可知1mol CO完全燃烧放出的热量为( )
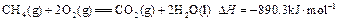 。现有0.75mol CH4和CO的混合气体,完全燃烧后生成CO2(g)和18g H2O(l),共放出515.9kJ热量,由上可知1mol CO完全燃烧放出的热量为( )
。现有0.75mol CH4和CO的混合气体,完全燃烧后生成CO2(g)和18g H2O(l),共放出515.9kJ热量,由上可知1mol CO完全燃烧放出的热量为( )A.283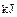 | B.374.4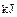 | C.512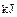 | D.566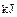 |
A
略

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
 。
。
 2SO3(g);△H =" a" kJ/mol,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答:
2SO3(g);△H =" a" kJ/mol,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答: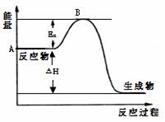
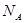 代表阿伏加德罗常数,则关于热化学方程式:C2H2(g) +
代表阿伏加德罗常数,则关于热化学方程式:C2H2(g) + 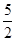 O2(g) ="===" 2 CO2(g) + H2O(l) △H="-1300" kJ/mol的说法中,正确的是( )
O2(g) ="===" 2 CO2(g) + H2O(l) △H="-1300" kJ/mol的说法中,正确的是( )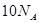 个电子转移时,该反应放出
个电子转移时,该反应放出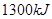 的能量
的能量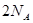 个碳氧共用电子对生成时,放出
个碳氧共用电子对生成时,放出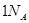 个水分子生成且为液体时,吸收
个水分子生成且为液体时,吸收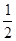 O2(g)=H2O(l) △H3="-285.8KJ/mol "
O2(g)=H2O(l) △H3="-285.8KJ/mol "  CH3OH (g) △H 1(反应Ⅰ)
CH3OH (g) △H 1(反应Ⅰ)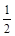 O2(g)=CO2(g) △H 2=-283 kJ·mol-
O2(g)=CO2(g) △H 2=-283 kJ·mol- 1 (反应Ⅱ)
1 (反应Ⅱ)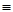 O
O O2(g)=CO2(g)+2H2O(g) △H4
O2(g)=CO2(g)+2H2O(g) △H4
 学式)
学式)