题目内容
18.下列反应属于取代反应的是( )| A. | 催化剂作用下,环氧丙烷和二氧化碳制备全降解塑料 | |
| B. | 催化剂作用下,乙烯和水制乙醇反应 | |
| C. | 乙醇在铜催化作用下与氧气的反应 | |
| D. | 甲烷和氯气光照条件下反应 |
分析 根据取代反应的定义“有机化合物分子里的某些原子或原子团被其它原子或原子团所代替的反应”进行判断.
解答 解:A.科学家研究发现:利用二氧化碳和环氧丙烷在催化剂作用下生成可降解聚碳酸酯,其反应原理可表示为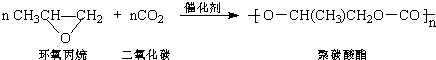 ,为聚合反应,故A错误;
,为聚合反应,故A错误;
B.乙烯和水制乙醇反应,为加成反应,碳碳双键生成碳碳单键,故B错误;
C.乙醇在铜催化作用下与氧气的反应生成乙醛,为氧化反应,故C错误;
D.甲烷和氯气光照条件下反应生成氯代烃,甲烷中的H原子被替代,为取代反应,故D正确.
故选D.
点评 本题考查了取代反应、加成反应和氧化反应的判断,难度不大,正确理解概念是解本题的关键,易错点为A,注意把握反应的特点..

练习册系列答案
相关题目
14.碘是一种重要的药用元素,缺乏碘能导致甲状腺肿大等.为预防碘缺乏病,目前我国的家用食盐都是“加碘食盐”.“加碘食盐”中的含碘元素的物质一般是( )
| A. | NaI | B. | KIO3 | C. | I2 | D. | AgI |
15.下列说法正确的是( )
| A. | 碰撞理论认为,反应物分子间必须相互碰撞才有可能发生反应,反应速率的大小与单位时间内反应物分子间有效碰撞的次数成正比 | |
| B. | 电解原理在生产中有着广泛的应用,工业上用电解熔融的氯化钠、氯化镁、氯化铝来冶炼Na、Mg、Al等活泼金属单质 | |
| C. | 盖斯定律表明,一个化学反应的焓变(△H)不仅与反应的起始和最终状态有关,还与反应的途径及过程有关 | |
| D. | 在工业生产中,研制出性能优良的催化剂可以使反应的温度降低,有效提高反应物的转化率,从而起到很好的节能效果 |
3.下列叙述正确的是( )
| A. | 原子半径:Al>Mg>Na | B. | 热稳定性:NH3>PH3>H2S | ||
| C. | 酸性:HClO4>H2SiO3>H3PO4 | D. | 元素非金属性:F>O>N |
10.下列物质能用来干燥NH3气体的是( )
| A. | 浓H2SO4 | B. | 碱石灰 | C. | 无水氯化钙 | D. | P2O5 |
7. 五种短周期元素的部分性质数据如下:
五种短周期元素的部分性质数据如下:
(1)Y元素简单阴离子的结构示意图为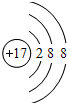 .
.
(2)关于Y、Z两种元素,下列叙述正确的是b(填序号).
a.简单离子的半径:Y>Z
b.气态氢化物的稳定性Y比Z强
c.最高价氧化物对应的水化物的酸性Z比Y强
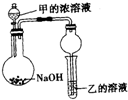
(3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物.某同学设计了如图所示装置(夹持仪器省)进行实验,将甲的浓溶液滴加到NaOH固体中,烧瓶中即有甲放出,一段时间后,观察到试管中的现象是白色沉淀生成,发生反应的离子方式是Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)XO2是导致光化学烟雾的“罪魁祸首”之一,其被氢氧化钠溶液吸收的化学方程式是:2XO2+2NaOH=M+NaXO3+H2O(已配平),产物M中元素X的化合价为+3.
 五种短周期元素的部分性质数据如下:
五种短周期元素的部分性质数据如下:| 元素代号 | T | X | Y | Z | W |
| 原子半径 (nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| 最高或最低化合价 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
 .
.(2)关于Y、Z两种元素,下列叙述正确的是b(填序号).
a.简单离子的半径:Y>Z
b.气态氢化物的稳定性Y比Z强
c.最高价氧化物对应的水化物的酸性Z比Y强
(3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物.某同学设计了如图所示装置(夹持仪器省)进行实验,将甲的浓溶液滴加到NaOH固体中,烧瓶中即有甲放出,一段时间后,观察到试管中的现象是白色沉淀生成,发生反应的离子方式是Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)XO2是导致光化学烟雾的“罪魁祸首”之一,其被氢氧化钠溶液吸收的化学方程式是:2XO2+2NaOH=M+NaXO3+H2O(已配平),产物M中元素X的化合价为+3.
 ,取代反应反应
,取代反应反应