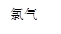��Ŀ����
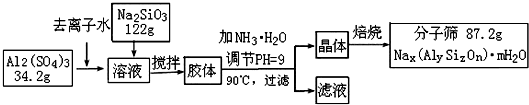
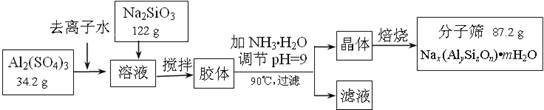
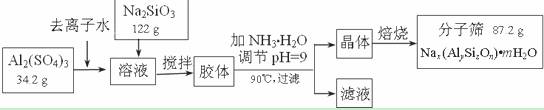
(12��)����ɸ���������ʵķ����ᴿ��ij���ͺŵķ���ɸ�Ĺ�ҵ�������̿ɼ�ʾ���£�
|
��1���ڼ�NH3��H2O����pH�Ĺ����У���pH���Ʋ�������Al(OH)3���ɡ���֪�����£�Al(OH)3��Һ��pH=3����Ksp=1��10-36��������c(Al3+)=���� �� ��
��2������������������Һ����Ҫ�ɷ�Ϊ���� �� ��д��ѧʽ����
��3������������������Ԫ�غ�Ԫ�ؾ�û����ģ���ԭ�ӵ�������Ϊ10������ͨ������ȷ���÷���ɸ�Ļ�ѧʽ��д��������̣���
��4������ɸ�Ŀ�ֱ��Ϊ4Å��Ϊ4A�ͷ���ɸ����Na+��Ca2+ȡ��ʱ���Ƶ�5A�ͷ���ɸ����Na+��K+ȡ��ʱ���Ƶ�3A�ͷ���ɸ��Ҫ��Ч���������飨����ֱ��Ϊ4.65Å�����춡�飨����ֱ��Ϊ5.6Å��Ӧ��ѡ������ �� �͵ķ���ɸ��
(12��)
��1��0.001 mol��L��1��2�֣� ��2��Na2SO4��(NH4)2SO4 ��2�֣�
��3�� n[Al2(SO4)3] = 34.2 g / 342 g��mol-1 = 0.1 mol��n(Na2SiO3) = 122 g / 122 g��mol-1 = 1 mol n(Al2O3) = 0.1 mol��n(SiO2) = 1 mol��n(Na2O) = 0.1 mol��n (H2O) = 0.6 mol��3�֣�
n(Na2O) ��n(Al2O3) ��n(SiO2) ��n(H2O) = 0.1 mol��0.1 mol�� 1mol��0.6 mol == 1��1��10��6
��ѧʽ��Na2O ��Al2O3 ��10SiO2 ��6H2O��Na2(Al2Si10O24)��6H2O��3�֣�
��4��5A��2�֣�

 ѧϰʵ����ϵ�д�
ѧϰʵ����ϵ�д�