题目内容
11.悉尼奥运会所用火炬燃料为65%丁烷和35%丙烷,已知丙烷的燃烧热为2221.5kJ•mol-1;正丁烷的燃烧热为2878kJ•mol-1;异丁烷的燃烧热为2869.6kJ•mol-1;下列有关说法正确的是( )| A. | 丙烷燃烧的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(g)△H=-2221.5kJ•mol-1 | |
| B. | 相同质量的正丁烷和丙烷分别完全燃烧,前者需要的氧气多,产生的热量也多 | |
| C. | 正丁烷比异丁烷稳定 | |
| D. | 奥运火炬燃烧时主要是将化学能转变为热能和光能 |
分析 A、方程式中各物质的状态没有标出;
B、相同物质的量的正丁烷质量比丙烷大,具有的能量多;
C、能量越高越不稳定;
D、有机物的燃烧时主要将化学能转变为热能和光能.
解答 解:A、丙烷的燃烧热为2221.5kJ/mol,说明完全燃烧1mol丙烷生成二氧化碳和液态水时会放出2221.5kJ的热量,热化学方程式为C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2221.5kJ/mol,选项中水是气体,故A错误;
B、相同物质的量的正丁烷质量比丙烷大,燃烧消耗的氧气多,具有的能量多,所以燃烧放出的热量多,相同质量的正丁烷物质的量小于丙烷,需要的氧气少,产生的热量也少,故B错误;
C、由数据可知,异丁烷的燃烧热比正丁烷的燃烧热小,则异丁烷的能量低,即热稳定性为:正丁烷<异丁烷,故C错误;
D、有机物的燃烧时释放能量,主要将化学能转变为热能和光能,故D正确;
故选:D.
点评 本题是一道关于化学反应中的能量变化的题目,可以根据燃烧热的概念、能量转化形式分析,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用如图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验).
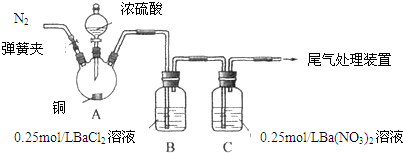
实验操作和现象:
(1)A中反应的化学方程式是Cu+2H2SO4$\stackrel{△}{→}$CuSO4+SO2↑+2H2O.
(2)C中白色沉淀是Ba2SO4,该沉淀的生成表明SO2具有还原性.
(3)C中液面上方生成浅棕色气体的化学方程式是2NO+O2=2NO2.
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是通N2一段时间,排除装置中的空气;乙在A、B间增加洗气瓶D,D中盛放的试剂是饱和NaHSO3溶液.
②进行实验,B中现象:甲--有大量白色沉淀;乙--有少量白色沉淀检验白色沉淀,发现均不溶于稀盐酸.结合离子方程式解释实验现象异同的原因:甲:SO42-+Ba2+→BaSO4↓,乙:2Ba2++2SO2+O2+2H2O→2BaSO4↓+4H+
白雾的量远多于装置中O2的量.
(5)合并(4)中两同学的方案进行实验.B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀.

实验操作和现象:
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | --- |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(2)C中白色沉淀是Ba2SO4,该沉淀的生成表明SO2具有还原性.
(3)C中液面上方生成浅棕色气体的化学方程式是2NO+O2=2NO2.
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是通N2一段时间,排除装置中的空气;乙在A、B间增加洗气瓶D,D中盛放的试剂是饱和NaHSO3溶液.
②进行实验,B中现象:甲--有大量白色沉淀;乙--有少量白色沉淀检验白色沉淀,发现均不溶于稀盐酸.结合离子方程式解释实验现象异同的原因:甲:SO42-+Ba2+→BaSO4↓,乙:2Ba2++2SO2+O2+2H2O→2BaSO4↓+4H+
白雾的量远多于装置中O2的量.
(5)合并(4)中两同学的方案进行实验.B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀.
2.下列各组物质中化学键的类型相同的是( )
| A. | HCl MgCl2NH4Cl | B. | H2O Na2O? CO2 | ||
| C. | CaCl2? NaOH H2O | D. | NH3•H2O CO2 |
19.下列实验操作中,正确的是( )
| A. | 用剩的药品不要乱丢,要放回原试剂瓶里 | |
| B. | 给试管里的液体加热,液体的体积一般不超过试管容积的$\frac{1}{3}$ | |
| C. | 试管和烧杯都可以直接在火焰上加热 | |
| D. | 加热后的蒸发皿,要用坩埚钳夹取 |
6.下列离子方程式书写正确的是( )
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 氢氧化镁与硫酸溶液反应:OH-+H+═H2O | |
| C. | 氢氧化钡溶液与稀硫酸的反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 将金属Cu加入FeCl3溶液中:2Fe3++Cu═2Fe2++Cu2+ |
16.影响化学反应速率的因素很多,下列措施中能减慢化学反应速率的是( )
| A. | 用铁粉代替铁钉与稀盐酸反应 | |
| B. | 将食物由常温保存改为在冰箱中保存 | |
| C. | 加入MnO2粉末做H2O2分解反应的催化剂 | |
| D. | 用 3 mol/L 的盐酸代替 1 mol/L 的盐酸与锌粒反应 |
3.下列关于化石燃料的说法错误的是( )
| A. | 石油中含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 煤是由有机化合物和无机物组成的复杂的混合物 | |
| D. | 煤中含有苯和甲苯,可以用分馏的方法把它们从煤中分离出来 |
20.下列气体不能用碱石灰干燥的是( )
| A. | H2 | B. | Cl2 | C. | NH3 | D. | CO |
1.维生素C的结构简式为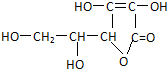 ,有关它的叙述,正确的是( )
,有关它的叙述,正确的是( )
 ,有关它的叙述,正确的是( )
,有关它的叙述,正确的是( )| A. | 分子中含有苯环 | B. | 能发生氧化反应和加成反应 | ||
| C. | 难溶于水 | D. | 在碱性溶液中能稳定地存在 |